热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
研究地点水样采集于新喀里多尼亚泻湖西南部(2000 km2),主要位于努美阿市(125000居民)附近和周围海湾(图1)。西南泻湖的平均深度为21m,主航道的平均深度为25m,而海湾站的深度稍浅(表1)。共有16个站沿3个样带取样,目的是获得较大的营养范围。
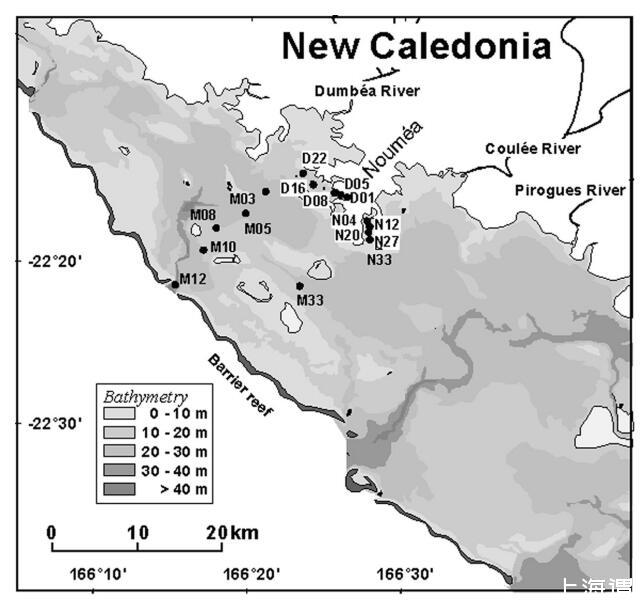
图1. 新喀里多尼亚西南泻湖和研究地点的位置。
“开放泻湖”样带(M03、M05、M08、M10、M12;图1)的测站因海水通过南部进入而迅速更新(Douillet 1998)。远离陆地和人为影响,这些站点通常是该地区营养最贫乏的站点。“圣玛丽”样带(N04、N12、N20、N27、N33、M33)位于富营养化的圣玛丽湾。这个海湾接收周围城市地区未经处理的废水。最后,“Grande Rade”站(D01、D05、D08、D16、D22)受到城市污水和镍工业污染物的影响。后两个地点的富营养化程度在海岸和海湾开放之间呈下降趋势。
由于氧气测量设备的可用性,一次只能对一个现场进行取样。对于每次取样,使用海鸟SBE 19 CTD探针记录水柱变量(电导率、温度、体内叶绿素荧光和光合有效辐射)。使用酸洗的5-L Niskin瓶在3m深处采集水样。先前的工作表明,该取样深度提供了整个水柱的代表性样本(Jacquet等人,unpubl.data unref.)。样品保存在尼斯金瓶中,直到90分钟内返回实验室。
细菌呼吸返回实验室后,立即通过125-µm的筛网对600µL的泻湖水进行预筛选,以消除可能增加整个群落耗氧量变化的较大、较不丰富的生物体。然后将过滤后的水分为两组水样:一组用于评估总群落呼吸的未过滤水样和一组过滤到0.6微米孔径的核孔膜上的水样。过滤是在低压差(<100毫米汞柱)下进行的,以避免破坏脆弱的细胞。然后将样品倒入250ml玻璃瓶中,用穿孔硅塞密封,插入微探针,并在±1°C的原位温度下在黑暗中孵化。使用磁力搅拌器使水均匀化。每次实验前,对培养容器、微探针、塞子和搅拌器进行酸洗(盐酸,最终体积的10%)。
用氧微探针连续测定呼吸。Microbes(Unisense,丹麦)采用外部保护阴极(Revsbech 1989)设计,电极本身的耗氧量极低(4.7至47×10–7 mmol O2 h–1)。探针的响应时间小于1s,精度为0.1µM。在14h(圣玛丽和格兰德拉德样品)或24h(开放泻湖样品)期间,每10s由计算机收集一次氧浓度。根据0.6µm过滤水样中的耗氧量估算细菌呼吸。根据5小时内测量的O2与时间的斜率计算细菌呼吸,我们假设该斜率足够短,以尽量减少细菌的产生和数量变化。从观察到氧气显著减少(0.5µM)中选择起始点。假设呼吸商为1,将耗氧量转换为呼吸碳量(µgC L–1 h–1)。
未过滤样品中的叶绿素a-叶绿素a浓度在过滤到GF/F过滤器后测定,该过滤器立即储存在-20°C下,直至分析。叶绿素a浓度后来根据Yentsch和Menzel方法(1963年)进行荧光测定。色素浓度由Lorenzen(1966)计算得出,Jeffrey和Humphrey(1975)对其进行了修改。
细菌丰度细菌丰度从立即用硼砂缓冲福尔马林(2%最终浓度)保存的样品中估算,过滤到0.2µm黑色聚碳酸酯膜上,用DAPI(4′6-二氨基-2-苯基吲哚)染色,并在-20°C下储存,直到荧光显微镜下计数。在至少20个字段中重复计数400多个细菌,以获得10%的变异系数(Kirchman等人,1982年)。在每次呼吸培养开始和结束时测定细菌丰度。
3H-胸腺嘧啶核苷的掺入细菌DNA合成,通过将3H-胸腺嘧啶核苷掺入冷三氯乙酸(TCA)可沉淀材料中来测定细菌产量。在原位温度(±1°C)下,用3H-[甲基]胸苷(最终浓度15 nM,1.8 TBq mmol–1,Amersham)在黑暗中培养5至10 mL水样的两份或三份,培养1 h。以前的实验表明,在这个浓度下,总是能达到饱和。通过添加缓冲福尔马林(最终浓度为2%)停止活性。通过0.2-µm聚碳酸酯膜在低压(<100 mm Hg)下过滤收集标记材料,并允许其在4°C下用冰冷TCA(5%w/v)沉淀15分钟。用5毫升5%冷TCA冲洗膜3次。然后用0.5 N HCl在100°C下加热30分钟水解DNA。加入4 mL闪烁鸡尾酒后,在淬火校正后,用Packard TriCarb闪烁计数器测量放射性。在每次呼吸培养开始和结束时测定细菌DNA合成。3H-胸腺嘧啶核苷掺入率使用2.91×1018细胞mol–1胸腺嘧啶核苷的转换因子转换为细胞产量(Jacquet unpubl.数据unref.)。
BGE测定一般情况下,BGE是根据从短培养时间(即~1小时)测定的胸腺嘧啶核苷或亮氨酸掺入估计的细菌产量,以及从培养24小时后测得的细菌呼吸(使用温克勒O2滴定法)计算得出的。在本研究中,BGE的计算公式如下:
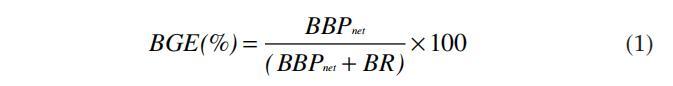
BBPnet为净细菌生物量生产量,即所考虑的培养时间开始和结束之间的细菌生物量差异,BR为细菌呼吸,以碳单位转换。细菌丰度(106个细胞mL-1)到碳生物量(µg C L-1)的转换是使用20个fgC细胞-1的转换因子完成的(Lee和Fuhrman 1987),尽管该因子仍存在相当大的不确定性(Fukuda et al.1998)。
使用氧微电极来研究细菌的呼吸作用以确定浮游细菌的生长速率——摘要
使用氧微电极来研究细菌的呼吸作用以确定浮游细菌的生长速率——材料和程序
 相关新闻
相关新闻