热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
探针耗氧量的方法学方法。 为了确保微探针的耗氧量与细菌的耗氧量相比可以忽略不计,我们在24小时内平行培养过程中监测了相同水的0.6-µm和0.2-µm过滤子样本中的氧浓度(图2)。 0.2-µm过滤水中的氧浓度在培养0至15 h期间保持恒定(215µm O2,图2)。 培养15小时后观察到的减少是由于通过过滤器的残留小细菌的生长和/或由于仪器无法进行高压灭菌而污染样品造成的。 对于在含有大多数细菌的0.6µm(图2)上过滤的样品(平均值为90%±4%,n=31,Torréton等人未经过滤的数据未经过滤),这种残留污染可以忽略不计。 微探针不消耗氧气是一个相当大的优势,因为在浮游水域中使用的大多数氧气测量设备都涉及氧气宏观探针(Griffith 1988;Langdon 1993),其显示内部氧气消耗,导致氧气消耗的高估,除非纠正。
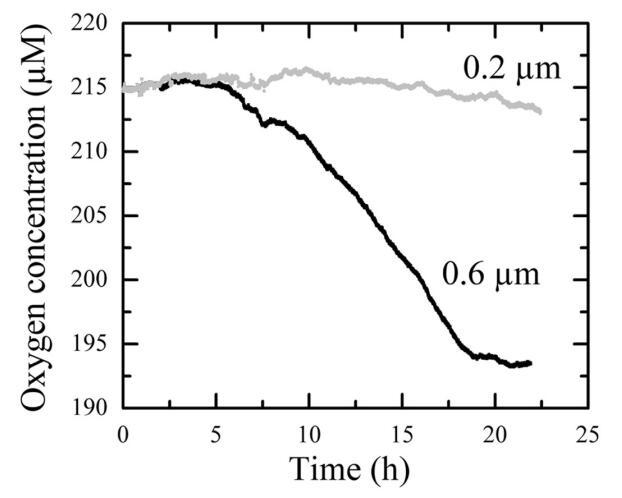
图2. 站N12(2003年5月6日)0.6-和0.2-µm过滤子样本暗培养期间的氧气浓度。
再现性。 使用Winkler方法的耗氧量估计通常是重复进行的。 在我们的研究中,测量氧气浓度的设备的可用性使我们无法在重复中系统地估计氧气消耗量。 然而,在一些情况下,我们检查了重复水样的再现性。 图3显示了同一站点的两个样本中氧气浓度的时间过程非常相似。
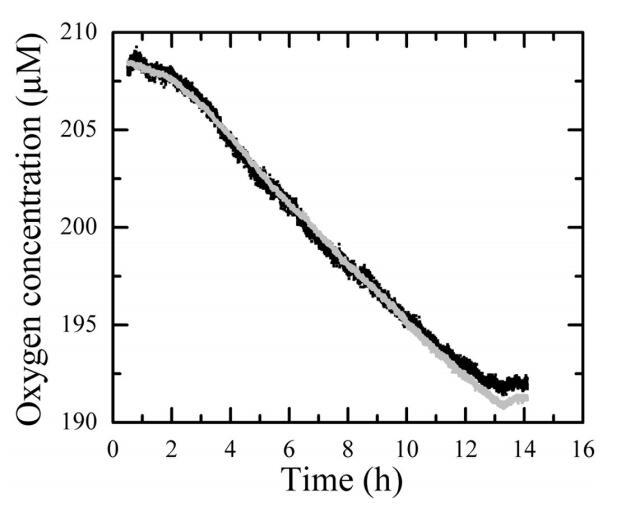
图3. 在N12站(2003年4月10日)0.6-µm过滤子样本的黑暗培养期间的氧气浓度。
氧微探针的精密度。 表2显示了用于测量浮游生物系统中氧浓度的不同技术。 Winkler技术是最常用的技术,已经开展了许多工作来提高这种化学测定氧浓度的精度。 氧微探针的精度(0.05%)相当于Roland等人(1999)和Sherr及Sherr(2003)所述的高精度Winkler技术。
<0.6-µm过滤样品中的呼吸趋势-离散O2或CO2测量用于估计呼吸的一个主要缺点是,它们需要较长的培养时间才能观察到与初始氧气浓度的显着差异。 然后假设耗氧量是线性的,这通常不容易用温克勒滴定法在短时间内验证。 在之前的一项研究中,Pomeroy等人(1994年)观察到在每5小时进行一次离散氧测量的24小时孵化期间氧浓度时间过程的不同趋势。 他们三分之一的数据没有显示氧浓度随时间的线性下降。 因此,他们建议持续监测氧气浓度,以便更好地估计细菌呼吸。 然后假设耗氧量是线性的,这通常不容易用温克勒滴定法在短时间内验证。在之前的一项研究中,Pomeroy等人(1994年)观察到在每5小时进行一次离散氧测量的24小时孵化期间氧浓度时间过程的不同趋势。他们三分之一的数据没有显示氧浓度随时间的线性下降。因此,他们建议持续监测氧气浓度,以便更好地估计细菌呼吸。
氧气微探针的使用使我们能够连续跟踪呼吸瓶中的氧气浓度。 然后将氧浓度数据与时间拟合成指数衰减方程,然后根据拟合函数的一阶导数计算呼吸的时间过程。 同时,在重复0.6-µm过滤样品的24小时黑暗培养期间,每5小时测定一次3H-胸腺嘧啶核苷掺入和细菌丰度。 图4显示了两种对比营养状态下(M10,贫营养状态,D01,富营养状态,见图1)的呼吸、细菌丰度和细菌产生的时间过程。
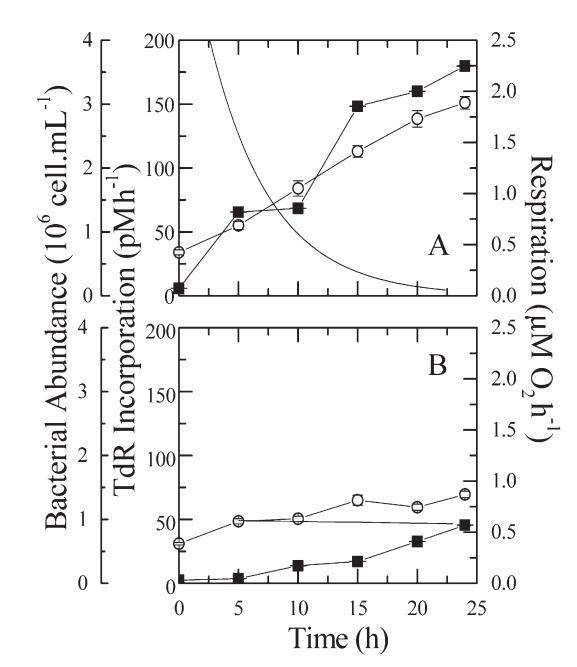
图4. 来自富营养化D01(a)和贫营养化场地M10(B)的0.6µm滤液的细菌丰度(?)、TdR掺入()和呼吸(-)。 条形代表标准偏差。
在富营养化现场样品中,显着的呼吸仅在2至3小时后出现(图4A),而在贫营养现场样品中,仅在8至10小时后出现(图4B)。
在D01(图4A)中,TdR掺入率显着增加,在孵育24小时内从6 pM h增加到180 pM h–1。 培养结束时,细菌丰度达到初始值的5倍。 呼吸在培养2小时后达到最大值(2.5µM O2 h–1),然后下降,直到培养15小时后变得几乎为零。 TdR和细菌丰度的增加表明细菌可能不受资源限制。 观察到的生产和消费之间的差异表明,正如del Giorgio和Cole(1998)所建议的,这两个过程之间存在时间上的不耦合。 培养结束时,细菌丰度达到初始值的5倍。呼吸在培养2小时后达到最大值(2.5µM O2 h–1),然后下降,直到培养15小时后变得几乎为零。TdR和细菌丰度的增加表明细菌可能不受资源限制。观察到的生产和消费之间的差异表明,正如del Giorgio和Cole(1998)所建议的,这两个过程之间存在时间上的不耦合。
来自寡营养部位的样本(图4B)在数小时的滞后期后显示胸腺嘧啶核苷掺入增加。类似地,显著呼吸仅在6小时的滞后期后才可测量,并且速率(0.6µM O2 h–1)在接下来的15小时内几乎保持不变,而胸腺嘧啶核苷掺入率持续增加,直到培养结束时达到45 pM TdR h–1。在最初的15小时内,细菌数量增加了2.5倍,并在1.4×106细胞mL–1附近达到一个平台。
这些结果允许优化培养时间,以测量贫营养和富营养场所异养细菌的耗氧量。此外,3H-胸腺嘧啶核苷掺入和细菌丰度的平行趋势证明了该方法的局限性。事实上,应谨慎解释结果,考虑到测量结果更能代表瓶内培养过程中发生的过程,而不是初始原位条件。
M10站的结果表明,只有当细菌数量和活性增加时,才能观察到显著的耗氧量。这种活性的增加可能是由于>0.6µm生物体的捕食释放、过滤过程中脆弱细胞的破坏、玻璃材料上有机物的瓶效应吸附和浓缩,或培养过程中细菌群落的变化(Schäfer等人,2000年;Massana等人,2001年;Fuchs等人,2000年;Gattuso等人,2002年)。Biddanda等人(1994年)已经表明,在墨西哥湾北部不同营养状态的水域中培养期间,细菌的丰度和活性都会增加。在他们的研究中,在培养20小时后,高产陆架水域和低产坡水域的细菌产量分别增加了12倍和8倍。Likew在ise中,富营养化场所的细菌丰度增加了1.5倍,而贫营养场所的细菌丰度保持不变。因此,在这些孵化过程中,群落的进化和活性测量并不能真正代表初始条件。
因此,最好在最短的时间内培养,以保持最接近初始条件。因此,我们选择以5小时间隔计算的斜率来测量细菌呼吸。这一时间是确保氧气浓度显著降低的最短时间和最小值之间的最佳折衷时间增加细菌DNA合成率(1.19±0.21倍)和丰度(1.42±0.09倍)。当我们观察到氧气显著减少时,选择间隔的开始。
连续O2测量与离散O2测量我们从16个营养状态对比的站点共收集了27个样本(表1)图5显示了我们研究期间观察到的氧浓度的不同时间过程。图6显示了估算细菌呼吸的离散方法和连续方法之间的比较。
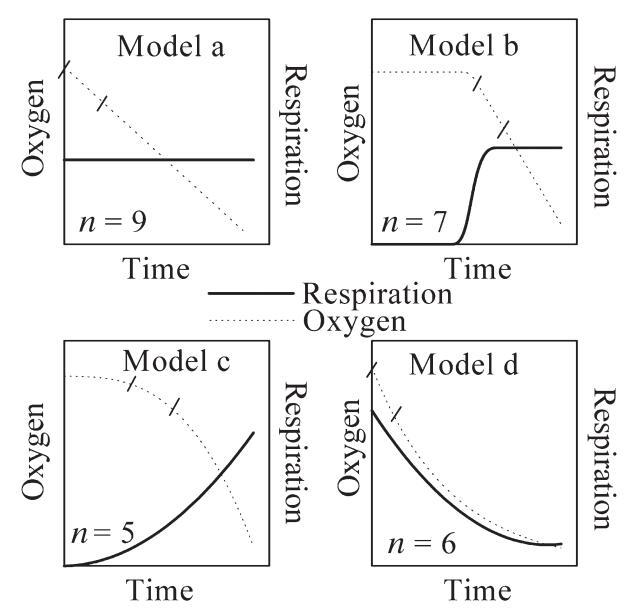
图5.氧气浓度和预测呼吸随时间变化的不同趋势表示。n表示我们研究期间观察到的相应病例数。两条线表示间隔(5小时)用于计算细菌呼吸。对于b型和c型,起始点从最小减少0.5µM O2开始设置(见正文)。
表1.在整个水柱上取样的站的平均特征
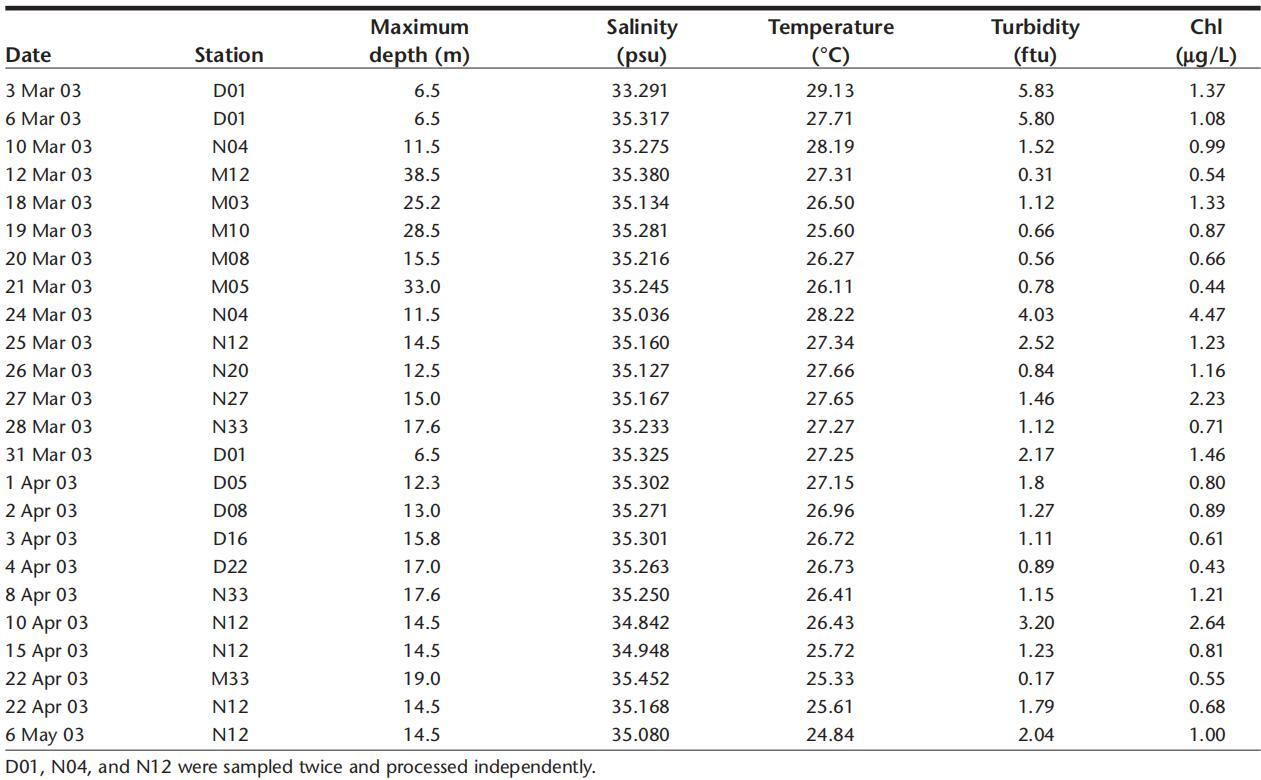
27例中只有9例在孵化期间表现出恒定的O2消耗(模型a,图5和图6)因此,在计算细菌呼吸时没有显示出重要的偏差。在模型a中,估计细菌呼吸的离散方法将给出与通过连续监测氧气浓度所估计的结果相似的结果。该模型表征了显示低净细菌产量的水样的呼吸(图7)。
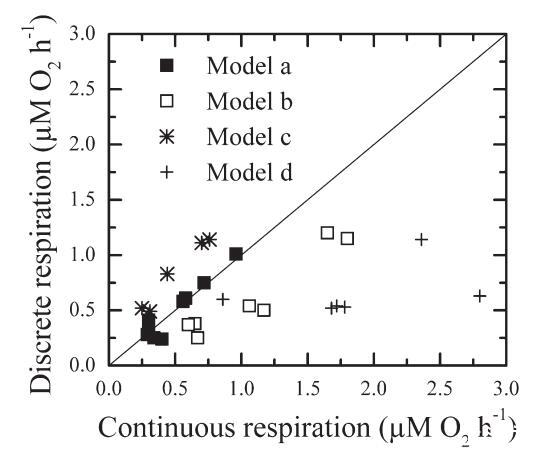
图6.通过离散和连续O2测量估计的呼吸比较。对于离散方法,呼吸是根据孵化开始和结束时(14小时或24小时)的氧气浓度之间的差异计算的。
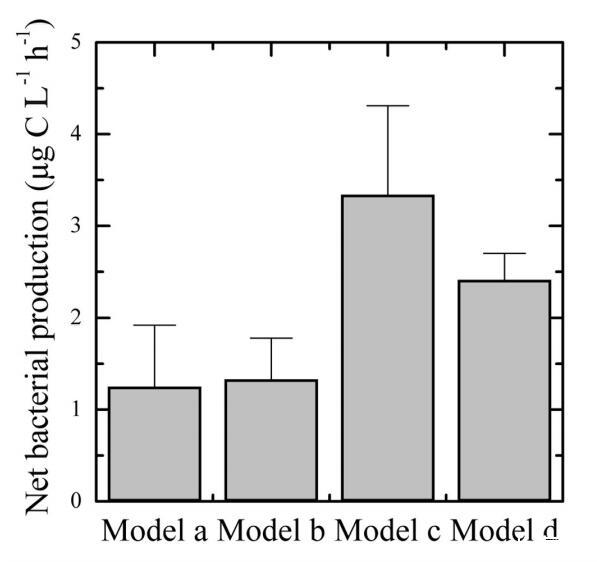
图7.培养过程中观察到的平均净细菌生物量的分布,作为耗氧量模型的函数。误差条表示标准偏差。
模型b在氧气减少之前呈现5到10小时的滞后阶段。一般来说,该模型是开放泻湖样带(图1)中寡营养样品(7个样品中的4个)的特征。在模型b中,通过离散方法估计的呼吸将导致氧消耗率的低估(图6)。正如模型a所观察到的,模型b是水样的特征,表现出较低的净细菌产量(图7)。在模型c中,由于生物量和产量的增加,消耗量随着时间的推移而增加。因此,与5小时时间间隔内的连续氧气记录相比,离散方法会高估BR(图6)。根据模型c呼吸的样本的特征是细菌净产量最高(图7)。最后,在模型d中,斜率在孵化开始时最大,随后减小。这种趋势是富营养化场所的特征,可能是由于营养资源的枯竭和随后异养细菌活性的降低。对于模型d,用于估计细菌呼吸的离散方法将导致比使用连续监测确定的值更低的速率(图6)。
这些不同的模型显示了氧动力学的巨大可变性,因此难以选择如何计算细菌耗氧量。同样,在之前的一项研究中,Pomeroy等人(1994年)从24小时培养期间进行的离散氧测量中观察到4种不同的氧趋势。即使在我们的研究中,模型a/b和c/d可以分配给不同营养状态的水,如细菌生物量净产量所示(图7),我们也不能将一个模型分配给任何特征点。这一结果强调了需要持续监测浮游微生物的耗氧量,以便以最小偏差评估呼吸速率。
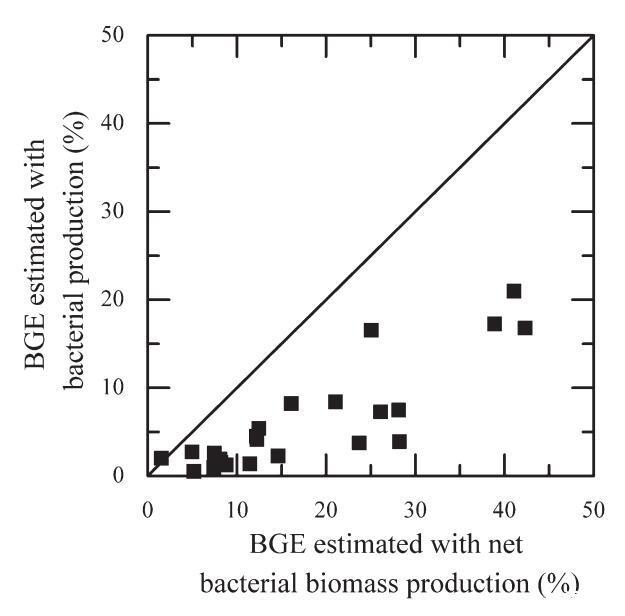
图8. 用细菌净生物量(bgebpnet)估算的BGE与用3H-胸腺嘧啶核苷掺入(BGEBP)测定的细菌产量估算的BGE之间的关系。
BGE-BGE的估计通常通过细菌呼吸计算的细菌产量(用3H亮氨酸或3H胸腺嘧啶核苷掺入测量)的替代物来确定。在我们的研究中,我们根据培养过程中观察到的用于细菌呼吸测定的丰度变化来估算净细菌生物量(见材料和程序)。这样,控制BGE的两个进程在相同的条件下确定。图8显示了用净细菌生物量产量(BGEBNET)估算的BGE与用3H-胸腺嘧啶核苷掺入(BGEBP)测定的细菌产量估算的BGE之间的关系。除了一个站点外,bgebpnet始终高于BGEBP。可使用线性回归(R2=0.75,n=24,P<0.001)将BGEBnet和BGEBP与以下等式关联:
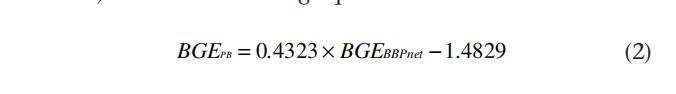
这一趋势表明,当根据示踪物掺入估算的细菌产量估算BGE时,将导致低估细菌生长效率。这一低估可能是由于确定两个过程的培养时间存在差异(TdR衍生细菌生产为1小时,细菌净生物量生产为12至24小时)。
用于估计BGE的24小时培养可导致生物量和细菌产量的强烈变化,如图4所示。细菌生物量和产量的这些变化会强烈影响BGE的测定。图9显示了根据图4所示数据计算的24小时孵育期间BGE的时间过程。在富营养化现场(D01),BGE在孵化开始时等于7%,并且随着时间的推移而强烈增加,在孵化20小时后达到53%的最大值。BGE的增加是由于孵化期间呼吸速率的强烈下降,伴随着恒定的净生物量细菌产量(图4A)。Coffin等人(1993年)观察到24小时培养期间细菌丰度和呼吸的类似模式,导致BGE有规律地增加。类似地,Pomeroy等人(1994年)观察到氧呼吸减少(使用多点Winkler滴定法)伴随着由亮氨酸掺入确定的细菌产量的规律性增加。这些观察到的两个过程的时间过程导致在孵化期间BGE有规律地增加。高初始呼吸速率伴随着低细菌产量(导致低BGE值)可能表明这两个过程并不像del Giorgio和Cole(1998)之前所建议的那样耦合。
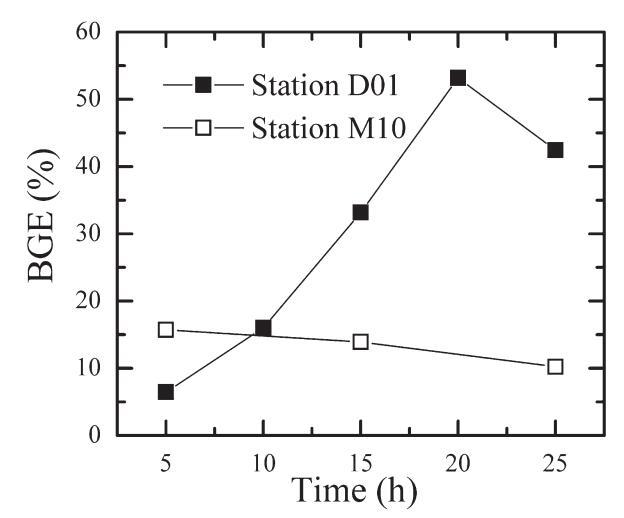
图9. 在两种对比营养状态下,BGE在24小时孵化期间的时间过程。 用于计算BGE的数据来自图4。 对于M10站,在10小时间隔内计算净生物量产量,以获得细菌丰度的显着变化。 在两种对比营养状态下,BGE在24小时孵化期间的时间过程。用于计算BGE的数据来自图4。对于M10站,在10小时间隔内计算净生物量产量,以获得细菌丰度的显著变化。
相反,在寡营养站点M10,呼吸作用和细菌净生物量的产生随时间保持不变(图4B)。 因此,BGE在孵化期间没有表现出显着的变化(图9)。 24小时培养期间BGE的可能变化,如在富营养化现场观察到的变化,强调有必要尽可能缩短培养时间,以尽量减少BGE测定中的偏差。 因此,BGE在孵化期间没有表现出显著的变化(图9)。24小时培养期间BGE的可能变化,如在富营养化现场观察到的变化,强调有必要尽可能缩短培养时间,以尽量减少BGE测定中的偏差。
使用氧微电极来研究细菌的呼吸作用以确定浮游细菌的生长速率——摘要
使用氧微电极来研究细菌的呼吸作用以确定浮游细菌的生长速率——材料和程序
 相关新闻
相关新闻