热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
粉红色浆果联合体的系统发育多样性:16S rRNA基因调查
对粉红色浆果聚集体中发现的16S rRNA基因的分析证明了一个一致的、简单的群落,其中两个系统发育型(定义为97%序列同一性聚类)占测序克隆的65%以上(来自三个样本的总共273个序列,图2一种)。PB-PSB1是最丰富的系统发育型(占序列的35-53%),是一种未培养的紫硫细菌(PSB),属于的Halochromatium-Thiohalocapsa谱系色科(支持信息,图S1)。

A.16S rRNA基因序列从粉红色浆果中分离出来,这些浆果采集于2011年(89克隆)彭赞斯角沼泽,2010年(94克隆)和2007年(90克隆)Little Sippewissett沼泽。两个操作分类单元(OTU),紫硫细菌(PB-PSB1)和硫酸盐还原菌(PB-SRB1),占观察到的序列的60%以上。
B.全长PB-SRB1 OTU和相关最大似然系统发育D esulfobulbaceae的。来自未培养生物的环境序列以灰色显示。超过50%的引导程序支持(500次复制)显示在节点上。分支长度(和比例尺)对应于各个分支上每个位点的平均核苷酸替换数。
第二丰富的种系型,PB-SRB1(序列15-35%),是最密切相关的Desulfofustis glycolicus,乙醇酸氧化硫酸盐还原在家庭Desulfobulbaceae(图2 B)。密切相关的PB-SRB1未经培养的生物体关联经常发现与参与硫氧化共生或通过硫化物氧化主导的环境的生物体(或化能或光养,图2的B)。除了硫酸盐的异化还原外,来自属的分离物Desulfofustis和Desulfocapsa在外已被证明通过源性硫化物清除剂存在下元素硫和硫代硫酸盐的歧化而生长(Finster等人,1998年;Finster,2008年)。
其余的16S rRNA基因序列主要是来自海洋硅藻的叶绿体和来自门的不同系统发育型拟杆菌。主要系统发育型拟杆菌的主要属于来自已知或疑似活性硫循环区域的环境序列进化枝,很少有培养的代表(支持信息,图S2)。对从粉红色浆果中扩增的18S rRNA基因序列的分析揭示了与羽状硅藻和甲藻相关的几种不同系统发育(支持信息,图S3)。出于这项工作的目的,我们进一步分析了主要浆果系统发育型PB-PSB1和PB-SRB1。
原位识别与空间布置
粉红色浆果由透明外聚合物基质中形状不规则的粉红色小管组成(图1 F)。粉红色浆果薄片的共聚焦显微镜显示,这些小管以紫色硫细菌为主,被鉴定为含有可折射元素硫包裹体的自发荧光球菌(直径2-4μm)(图3)。这些折射性内含物在溶剂(甲醇、乙醇)和洗涤剂(SDS、Triton X100)中不稳定,证实了它们是细胞内元素硫球。这些细胞还通过催化报告基因沉积-荧光原位杂交(CARD-FISH)使用GAM42a组特异性探针进行荧光标记,该探针与来自16S rRNA杂交Gammaproteobacteria的(Manz等,1992;支持信息,图S4)。
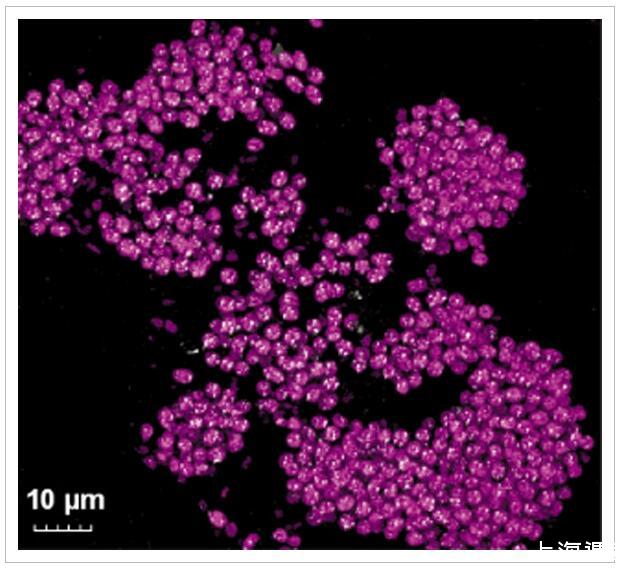
图3
切片粉红色浆果组织的表面反射共聚焦显微镜。紫色硫细菌的自发荧光(激发543 nm,发射550–570 nm)以粉红色显示,来自可折射元素硫包裹体的反射信号以白色显示。
PB-SRB1物种通过CARD-FISH定位,使用从16S rRNA基因库设计的系统发育特异性探针(SRB-PiBe213;本研究)。SRB-PiBe213探针与3μm长的杆杂交,这些杆丰富且散布在PB-PSB1细胞的密集岛中(图4)。使用靶向Deltaproteobacteria[DELTA495a-c;Lücker及其同事(2007年)]。与SRB-PiBe213探针杂交的游离细胞很少见(<总细胞数的1%),但可以在潮间带水池的上覆水中检测到(数据未显示)。还发现覆盖的池水和附近潮汐通道中的粉红色沙块含有球状PSB细胞的微观聚集体,以及与SRB-PiBe213探针杂交的杆状细胞。最小的聚集体仅包含5-6个总细胞,而较大的微聚集体的直径为20-50μm(数据未显示)。
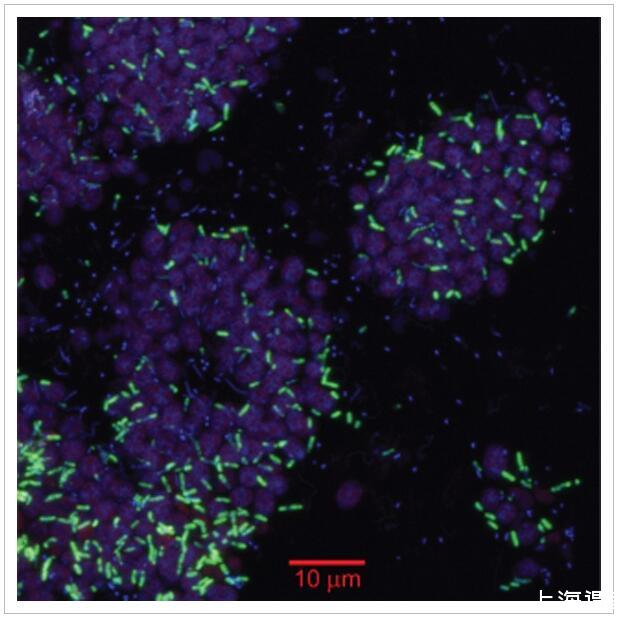
图4
使用系统发育特异性探针通过催化报告基因沉积-荧光原位杂交(CARD-FISH)鉴定浆果相关的PB-SRB1物种。扫描共聚焦显微照片显示了来自聚集体外围附近的粉红色浆果生物量的横截面。该图像是三个荧光信号的叠加:自发荧光紫硫细菌(以粉红色显示,激发543 nm,发射550–570 nm),来自SRB-PiBe213探针的CARD-FISH信号(以绿色显示,Alexa 488酪胺)和DAPI核酸染色剂(以蓝色显示)。
系统发育多样性的宏基因组分析
还使用未组装的Illumina鸟枪宏基因组数据研究了粉红色浆果中微生物的多样性,这避免了聚合酶链反应(PCR)扩增中固有的偏差。宏基因组数据中不同分类群的丰度和多样性使用核糖体RNA基因序列(Meyer进行评估et al.,2008)和保守的系统发育标记基因(Darling et al.,2014)。在鸟枪法宏基因组序列中观察到的多样性概括了基于PCR的调查(图5)。一个显着的例外是存在大量Alphaproteobacteria猎枪数据中,由代表驱动红细菌目(Oceanicola和Oceanicaulis物种)和红螺菌目的。根据针对SILVA和核糖体数据库项目(RDP)数据库的计算机内特异性搜索(数据未显示),这种差异可能是由于“通用”8F细菌引物引入的偏差,该引物无法很好地覆盖这些订单中的生物体。
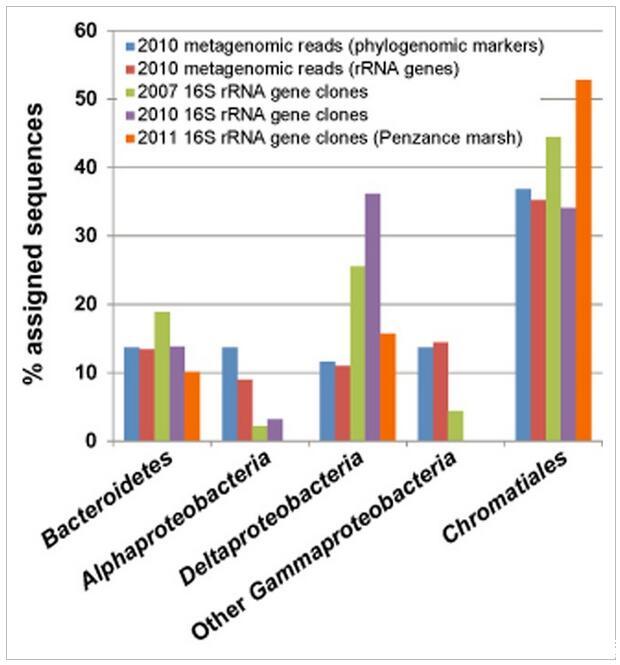
图5
来自16S rDNA PCR扩增的克隆文库与未组装的250 bp双端Illumina宏基因组读数的细菌多样性估计值的比较。宏基因组数据使用两种不同的方法进行分析:通过Phylosift将最大似然读数放置到系统发育保守的蛋白质编码标记基因(“系统基因组标记”)上,或通过MG-RAST的M5RNA管道读取与核糖体RNA基因的序列相似性。共有42 351个宏基因组读数被归类为细菌核糖体RNA序列,44 980个读数被归类为细菌系统发育标记基因。
使用共同组装的Roche 454 Titanium和Illumina HiSeq序列数据对微生物多样性进行了进一步的宏基因组分析。针对社区基因组学优化的策略(Peng等人,2012年)用于组装7400个大于1千碱基(kb;N50 1.6 kb,最大重叠群64 kb)的支架。宏基因组支架的聚类(参见实验程序)揭示了属于PB-PSB1(20-25倍覆盖)和PB-SRB1(15-20倍覆盖)的两个明确定义的箱。这些基因组箱的覆盖深度对应于16S rRNA基因PCR数据中观察到的PB-SRB1与PB-PSB1的丰度比(每1.1-1.7个PB-PSB1细胞1个PB-SRB1 RB)。这些基因组箱代表PB-SRB1和PB-PSB1的近乎完整的基因组,通过组装序列长度、编码特征的数量和对45个单拷贝系统发育标记基因的分析进行评估(参见支持信息,表S1)。在本研究中,我们将这些基因组的进一步分析重点放在与这些生物的硫基代谢相关的途径上。
硫循环的宏基因组证据
为了评估浆果中硫循环生物的多样性,我们将未组装的宏基因组序列读数映射到异化亚硫酸盐还原酶基因(基因dsrAB,参见实验程序)的系统发育,这些是氧化和还原异化硫代谢的广泛使用的系统发育标记(洛伊等人,2008年)。大约33%与比对的dsrAB读数序列无法通过这种方法进行分类,可能是因为它们源自系统发育无信息区域dsrAB基因的。大多数分类读取被放置在Chromatiaceae(44%)或Desulfobulbaceae(13%,Supporting Information,Fig.S5)中。在这些家族中,大部分读数被分配到Halochromatium salexigens(Chromatiaceae)和Desulfofustisglycolicus(Desulfobulbaceae),与显性16S rRNA基因序列的系统发育隶属关系一致。剩余的分类读数(总比对读数的10%)分布在Desulfobacteraceae和Desulfotomaculum中。
为了进一步表征粉红色浆果硫氧化还原循环的潜力,我们从完整组装的宏基因组数据集中确定了硫酸盐还原和硫化物氧化的途径。虽然在还原和氧化途径中使用了许多相同的基因,但可以通过不同的序列和基因组背景清楚地区分同源物。通过基于独立序列组成的分析,在与PB-PSB1分箱的支架上发现了所有鉴定的硫氧化基因,而硫还原基因位于PB-SRB1分箱中的支架上。PB-PSB1和PB-SRB1基因组中氧化和还原代谢途径的详细讨论见支持信息S1、支持信息S2、表S2和图S7-12
可溶性硫地球化学:物种形成、丰度和同位素组成
在缺氧过滤消毒的沼泽水中照亮的浆果微观世界不会产生可通过Cline测定检测到的硫化物(Cline,1969年),而是在两天内迅速消耗了1 mM添加的硫化物(图6 A)。为了研究聚集体中的硫形态和氧化还原环境,我们使用插入大浆果(直径约0.5厘米)的金汞合金微电极进行了循环伏安法。从聚集体内部测量的伏安图显示电位为0.85 V(相对于Ag/AgCl)的峰值,随着电极穿入和穿出浆果而变化。该测量对应于在内部浆果不同点13和41之间μM硫化物的浓度(图6 B;还参见Supporting Information,Fig.S6)。使用克拉克型硫化物微电极(Unisense,Aarhus,Denmark)在其他大浆果内部进行的独立分析表明存在5–20μM的H 2 S(135–540μM的总硫化物)。到通过循环伏安法可检测到的其他电活性物质(例如O 2、Fe 3+、Fe 2+、Mn 2+和As 3+在浆果中没有观察、连四硫酸盐、溶解/纳米颗粒元素硫)。
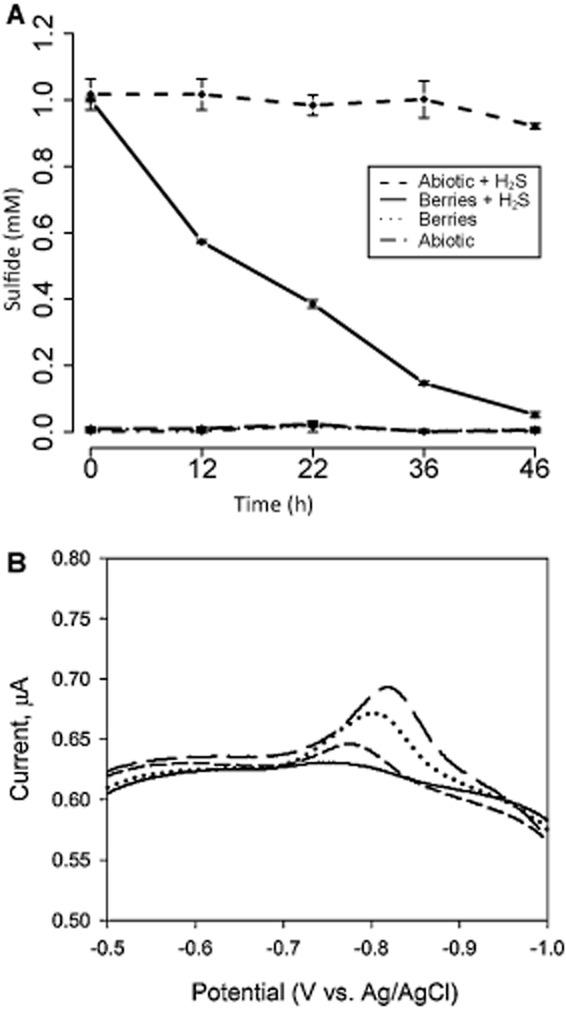
图6
A.在50毫升过滤消毒的沼泽水中用50个小浆果进行微观孵化时,通过Cline测定法测量硫化物浓度。孵育保持在14小时光照、10小时黑暗循环中。在浆果存在下的孵育过程中消耗了添加至1 mM浓度的硫化物(实线),而非生物对照显示没有变化(虚线)。没有添加硫化物的微观世界从接近0 mM的初始硫化物浓度没有可检测到的变化。误差棒显示三个生物重复孵化的标准偏差。
B.对直径约0.5厘米的粉红色浆果内的金汞合金电极进行伏安扫描显示,当电极尖端穿透浆果时,在约-0.8 V(相对于Ag/AgCl)处出现与溶解硫化物相关的明显峰。由于几乎无法控制电极在浆果中的确切位置,因此数据并未量化硫化物的梯度,而是概述了整个聚合体中位置和相对值的变化。当电极在周围的水中并且没有穿透聚集体时,收集到没有明显峰的实线。
为了研究浆果中硫化物的同位素组成,将大的聚集体(直径约0.5厘米)穿在24号银线上并孵育过夜原位(图7A)。可溶性硫化物以硫化银的形式沉淀在焊丝上,在每个聚集体下方留下带有金属光泽的黑色光泽(图7 B)。可见的硫化物积累开始于聚集体的表面下方,最暗的硫化物沉积在聚集体的中心,证实了来自微伏安法和硫化物微传感器的硫化物报告。随后使用IMS 7f-GEO扇形磁场二次离子质谱仪(SIMS;CAMECA,Gennevilliers,France)按照Fike及其同事(描述的方法分析了这种沉淀的硫化银的丰度和同位素组成2009年)。沿着穿过两个浆果的线的横断面显示32 S计数(硫化物丰度)增加,δ减少34 S朝着聚集体中心(图7 C)。在未发生可见硫化物沉积的情况下(即在浆果边缘或浆果之间),32 S计数也非常低(图7 C)。
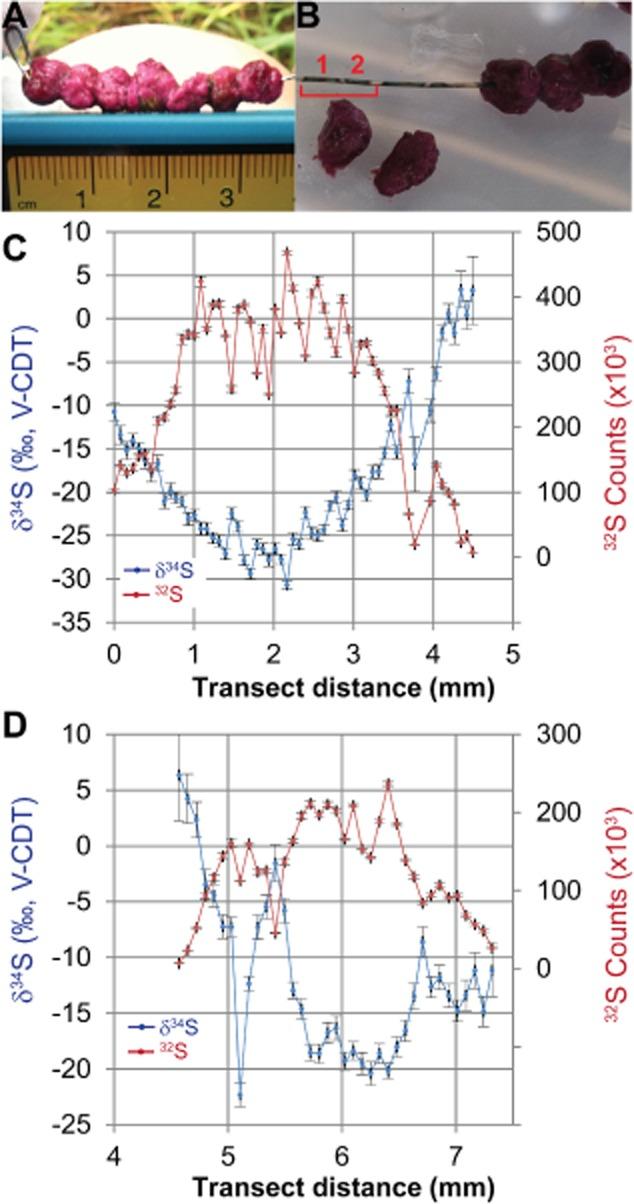
图7
A.将大的粉红色浆果穿在24号银线上并孵育原位过夜。
B.浆果内产生的硫化物沉淀到金属丝表面,形成一层AgS薄膜,可见浆果所在的黑色金属光泽。SIMS7f离子微探针分析是在横断面(25μm光斑尺寸)中进行的,沿着导线穿过来自两个不同浆果的AgS薄膜,这些浆果分别用红色数字1和2标记,分别显示在面板C和D中。
光盘。y轴上共同绘制的是的硫丰度(32 S计数,红色)和δ34沿横断面(x轴)每个点S(蓝色)。垂直误差条代表的标准误差(n每次测量=20个循环)。浆果1和浆果2之间32 S计数接近0的区域对应于导线上看不到深色硫化物膜的区域。图7的SIMS数据也已在支持信息S2中提供。
的δ34沉积硫化物S范围从聚集体边缘的~6‰到聚集体中心的-31‰。相对于第一个浆果,沉积在横断面第二个浆果中心的硫化物显示出较低的32 S计数和较少的同位素消耗(δ34 S为-20‰)(图7 C)。潮间带水体硫酸盐δ34 S为+22‰;因此,这些“浆果内”同位素值表明同位素分馏范围从∼15‰到53‰。相比之下,在附近沉积物表面孵育但未穿透浆果(例如图中最左侧的环)的银丝7Aδ34具有-16±2‰的S(平均值±SD,n=15)沿线均匀分布。
使用通过稳定同位素探测研究硫循环34 SO 4和nanoSIMS
为了跟踪联盟成员之间硫代谢和循环的活动,将新鲜收集的粉红色浆果与下厌氧培养34富含S的硫酸盐和富含13 C的碳酸氢盐在光照和黑暗条件。,富集34培养4天后S在形态独特的PB-PSB1细胞中的很明显(图8A和B)。的34 S/32这些细胞中S比率大约是未标记对照条件下观察到的两倍。发现该信号在甲醇中不稳定(图甲醇8 C),是一种用于定量萃取元素硫的溶剂(Ferdelman等,1997)。富集34 S IN光亮和黑暗孵育(图中记载8 C)。
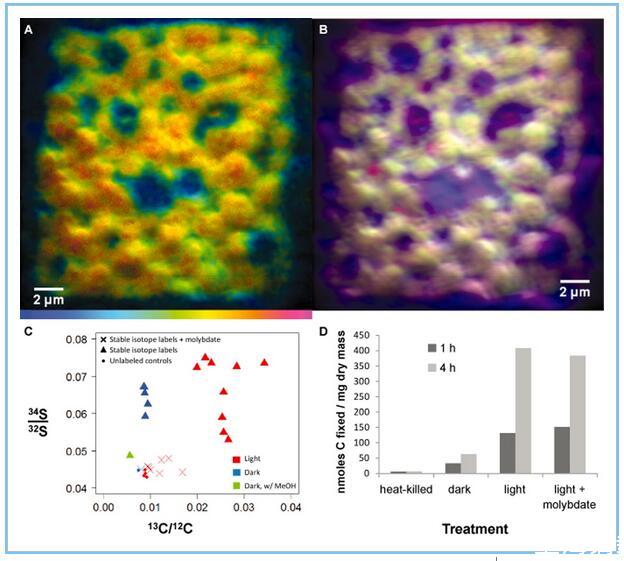
图8
用同位素标记的粉红色浆果的NanoSIMS分析34富含S的硫酸盐和富含13 C的碳酸氢盐。
A.色相-饱和度-强度图像映射34 S:32 S比率。色标范围从蓝色(设置为在未标记的控制条件下观察到的基线比率(0.044))到红色,其中该比率相对于基线(0.08)增加了约2倍。显示的图像是来自聚集体外围附近的粉红色浆果生物量横截面的复合八个连续30μm帧,分辨率为512×512像素。
B.来自叠加的初级离子信号的RGB合成图像,显示了形态独特的紫硫细菌细胞的细胞排列。叠加的初级离子图像是12 C离子(蓝色)、12 C 14 N(绿色)和32 S(红色)。提供的每个质量的基础离子图像支持信息S2中。
C.NanoSIMS计算的稳定同位素标记的平均掺入13 C-碳酸氢盐(x轴)和34 S-硫酸盐(y轴)在黑暗(蓝色)或12小时光/暗循环(红色)中孵育4天的在活性硫酸盐呼吸(三角形)或钼酸钠(X)抑制SRB的条件下,与未标记的对照孵育(点)进行比较。用甲醇(绿色三角形)对同位素标记的深色孵育浆果进行后处理。绘制的值是来自不同区域的15×15μm(浅色)或30×30μm(深色)栅格的平均值,总共七个聚合体(每个条件一个)。
D.将14 C碳酸氢盐掺入与1 mM硫化物一起孵育1小时或4小时的五个浆果中的酸稳定产品中。对热灭活的聚集体、暗平衡聚集体和在光照下添加和不添加10 mM钼酸盐的聚集体进行孵育。
积累34 S同位素标记的似乎取决于聚集体中硫酸盐还原生物的活性;此外钼酸钠(NaMoO的4),硫酸还原的抑制剂(Oremland和卡彭,1988),阻断的掺入34 S-富集标签(图8 C)。发音的34 S-富集(1100±200‰为三次重复温育)在散装浆果生物质中观察到从孵育用34 S-富集硫酸盐,如通过元素分析仪同位素比率质谱仪(确定支持信息,图S13)。未标记的对照和钼酸盐处理的散装生物质的同位素组成与直接从沼泽中取样的天然浆果相当(δ34 S值范围从-15‰到-24‰)。
碳固定是光依赖性的,如通过nanoSIMS测量所评估的13 C掺入(图8 C)和放射性标记(14 C)碳酸氢盐孵育测定(图8 D)的,表明PB-PSB1作为主要生产者在聚合中。钼酸孵育不影响在短期温育(1-4 1H)碳的光依赖性固定,表明PB-PSB1不是直接由钼酸(图抑制8 d)。在4天的温育,钼酸发现以降低聚集体碳固定在光,这表明较长的持续时间的治疗钼酸强加限制硫化物,从而降低PB-PSB1的初级生产力(图8 C)。
《盐碱地沼泽中的光养粉红色贝类的微量硫循环》——概括 、介绍