热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
紧密耦合的微生物群落在时空尺度上调节生物地球化学循环,这通常无法通过传统分析方法进行检测。粉红色浆果提供了一个可访问的模型系统来研究与聚集体相关的“神秘”硫循环,这一过程可能在全球生物地球化学转化中发挥重要作用。例如,在海洋系统中,据报道,在来自最低氧区的未检测到硫化物的区域中存在丰富的硫化物氧化谱系(SUP05、SAR324、Agg47)(Walsh等人,2009年;Canfield等人,2010年;Fuchsman等人)al.,2011)到含氧深海(Swan et al.,2011)。有关这些硫化物氧化谱系与下沉有机颗粒(海洋雪)相关的报告表明,它们与硫酸盐还原物种存在同养伙伴关系,尽管尚未证明这种还原硫化合物的种间转移。最近的工作还表明,来自酸性矿山排水的聚生体(Norlund都发生了种间硫转移等人,2009年)和负责深海甲烷厌氧氧化的同养聚生体(Milucka等人,2012年)。
粉红色浆果,主要由紫色硫细菌物种(PB-PSB1,Chromatiaceae)和推定的硫酸盐还原细菌物种(PB-SRB1,聚生体Desulfobulbaceae)组成的,提供了一个易于处理的系统来开始解密驱动硫循环的微生物代谢伙伴关系在微观层面。基于系统发育信息(即这些物种养殖近缘种的生理学)和粉红色浆果的保守空间结构的组合,我们假设PB-SRB1对浆果内硫酸盐的还原为PB-PSB1提供了硫化物的局部来源(图.9).即使在外源硫化物含量低或不存在的情况下,这种关联也会使PB-PSB1保持光合活性,例如在峰值光照条件下,当沉积物中的趋化层相对于其夜间水平向下移动几厘米时(Revsbech等人,1983年);狄龙等人,2009年)。驱动硫酸盐还原的电子供体可以由光合产物局部提供,也可以由沉积物外源提供(图9)。宏基因组测序证实了这种浆果内硫循环的遗传潜力;硫酸盐还原和硫化物氧化的完整代谢途径分别存在于PB-SRB1和PB-PSB1的基因组中。
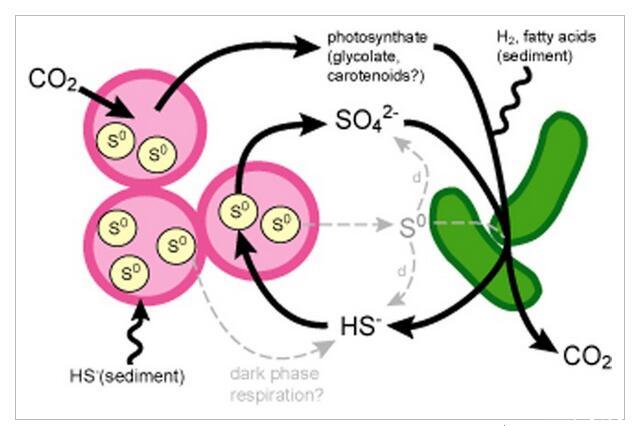
图9
粉红色浆果财团中硫循环的模型。PB-SRB1(绿色棒)将硫酸盐还原为硫化物,氧化来自外源沉积物来源或由PB-PSB1产生的本地提供的光合产物的各种电子供体。PB-PSB1(粉红色球菌)消耗自养硫化物,将硫化物氧化成硫酸盐,并在细胞内储存元素硫(S 0,淡黄色圆圈)。如果PB-PSB1细胞裂解,PB-SRB1(灰色虚线箭头)可能会减少和/或使细胞内硫不成比例。PB-PSB1(HS一些电子供体-)和PB-SRB1(H 2或脂肪酸)的也可能由沉积物流出的化合物(波浪线)外源提供。白天,光养型PB-PSB1将CO固定2到生物质中,而在夜间,它可以通过呼吸元素硫和细胞内碳水化合物储备并产生硫化物来获取维持能量。尽管PB-SRB1基因组表明具有固定CO的遗传潜力2,但我们的稳定和放射性碳实验的结果表明,在我们的孵化条件下,PB-SRB1对浆果中的碳固定没有显着贡献。
为了测试这种代谢模型,使用高分辨率地球化学方法(SIMS、nanoSIMS、微伏安法)来跟踪从硫代谢物库到细胞特异性硫同化和生物分子的神秘硫循环。Sulfur-34稳定同位素标记使我们能够跟踪聚集体中硫的流动,从PB-SRB1对硫酸盐的还原,到种间转移和掺入PB-PSB1细胞。在与孵育后34富含S的硫酸盐,我们在PB-PSB1细胞中观察到点状、溶剂不稳定的硫34富集(图8),这与细胞内硫球中标记硫的积累一致(图3)。
PB-PSB1的这种硫34富集不太可能通过直接掺入同位素标记的硫酸盐而发生。的细胞硫Chromatiaceae物种主要由元素硫的周质储存(细胞总重量的34%)支配,它完全来自还原硫池(Dahl和Prange,2006年)。此外,许多染色科,包括与PB-PSB1最接近的培养近缘种,无法同化硫酸盐(Dahl,2008;Kumar et al.,2009)。即使在那些可以同化硫酸盐的物种中,这一过程也被认为在缺氧光石营养生长过程中受到抑制(Neumann等人,2000年;Sander和Dahl,2008年)。在光有机营养生长过程中,模型Chromatiaceae物种Allochromatium vinosum通过cysTWA硫酸盐ABC转运蛋白和硫酸盐cysDN解酶同化ATP-硫同化。这些基因的同源物在PB-PSB1基因组中未发现,以及对整个组装宏基因组数据恢复搜索从基因更密切相关的那些从生物体只有遥远的序列匹配拟杆菌,α-变形菌或Desulfobulbaceae。
由于直接34 PB-PSB1细胞不太可能掺入S-硫酸盐,我们建议PB-SRB1将34 S-硫酸盐标记还原为硫化物,然后被PB-PSB1吸收并重新氧化为元素硫(图3)。9)。与此解释相一致,我们发现,粉红色浆果迅速氧化硫化物(图6 A)和的积累34在PB-PSB1 S-标签被依赖于硫酸盐还原细菌(图的活性8 C)。当钼酸钠抑制硫酸盐还原时,未观察到Sulfur-34富集。虽然将“特定”抑制剂(例如钼酸盐)应用于混合微生物种群可能会对非目标生物产生意想不到的后果(Oremland和Capone,1988年),但我们已经通过证明红外线不会直接抑制PB-PSB1在外源硫化物存在的情况下,在短时间(1-4小时)孵育期间的光依赖性碳固定(图8 D)。在较长的温育,其中外源硫化物成为限制性的(4天),钼酸治疗减少碳(图的光依赖性固定8 C)。SRB抑制导致初级生产力的降低支持了这样的假设,即自养供应的硫化物缓冲液PB-PSB1免受间歇性硫化物剥夺。
在确定了粉红色浆果中硫酸盐还原的重要性之后,我们试图描述粉红色浆果中还原硫的池。PB-SRB1和PB-PSB1的密切物理关联(图4)表明还原硫物质的再氧化发生在非常短的时空尺度上。以前使用克拉克型硫化物微电极的研究无法检测到硫化物(Seitz等,1993年),我们只能偶尔使用微伏安法和克拉克型硫化物微电极测量非常大的聚集体中微摩尔浓度的硫化物(图.6乙)。硫化物池的短暂性质支持我们在这种密切耦合的代谢伙伴关系中快速消耗硫化物的预测。在我们描述的条件下,观察到粉红色浆果是硫化物的净消费者。然而,消费和生产之间的这种平衡可能受到许多因素(例如光周期的强度和持续时间、温度、电子供体供应)的影响,需要进一步研究以更好地阐明聚生体中硫化物通量的决定因素。
在浆果中检测到的这种硫化物的最可能来源是PB-SRB1对硫酸盐的还原。然而,硫化物也可以通过其他几种代谢过程产生(图9),包括:(i)PB-SRB1还原元素硫,(ii)PB-SRB1使元素硫或硫代硫酸盐歧化或(iii)PB-PSB1对储存的碳水化合物进行暗相呼吸并伴随周质元素硫储备的减少,产生聚羟基链烷酸酯和硫化物(van Gemerden,1968年;Rothermich等,2000年)。为了进一步了解粉红色浆果硫循环的地球化学,我们表征了这种浆果内硫化物的空间分布和稳定同位素组成。
硫的氧化池和还原池之间稳定同位素比率的差异被广泛用于硫循环的现代和古生态重建(Canfield和Teske,1996年;Habicht等人,1998年;Canfield,2001年;Hurtgen等人,2005年;Fike等人,2006年;Fike和Grotzinger,2008年;Sim等人,2011a)。由无氧光养生物(例如PB-PSB1)介导的硫化物氧化被认为对硫同位素的分馏影响很小(Ivanov等人,1977年;Fry等人,1984年;1985年;Zerkle等人,2009年)。然而,硫酸盐还原和硫歧化都可以产生相对于起始硫酸盐库而言重稳定同位素显着耗尽的硫化物(Canfield,2001年;Sim等,2011a)。尽管广泛使用硫同位素分馏来推断硫循环,但我们对这些测量中编码的微生物代谢信息的理解主要基于单一物种的纯培养研究(Kaplan和Rittenberg,1964年;Kemp和Thode,1968年;Sim et al.,2011b)或在微生物群落特征较差的原位地球化学测量中(Habicht和Canfield,2001;Brüchert,2004)。
毫米大小的粉红色浆果聚生体提供了一个约束良好的多物种生态系统,可以在其中检查硫同位素组成(δ微米级空间变化34 S硫化物)的。在银线上使用硫化物捕获,该技术最初用于放射性示踪剂35 S测量(Cohen,1984年;Visscher等人,2000年;Dubilier等人,2001年),结合SIMSδ34 S测量,阐明了增加的梯度硫化物浓度和同位素消耗(较低的δ34从外围到大粉红色浆果中心的S值)(图7)。在浆果中观察到的这些同位素地球化学梯度类似于到的δ34 S硫化物从银盘上SIMS横断面观察趋势,穿过格雷罗内格罗光合垫的氧化层(Fike和Grotzinger,2008年;Fike等人,2008年;2009年)。
在浆果中观察到的硫化物-硫酸盐分馏范围(外围15‰至聚集体中心53‰)与硫酸盐还原菌纯培养物报告的值一致,范围从0‰到66‰(Sim等,2011a)。大的同位素分馏,例如在浆果中心观察到的那些,可以由(i)缓慢生长的硫酸盐还原细菌与难治性或生长限制浓度的电子供体一起产生(Sim等人,2011a,b;Leavitt等人,2013年),或(ii)还原和氧化过程耦合代谢活动的逐步方式(例如PB-PSB1的光养硫化物氧化或PB-SRB1的中间氧化态硫歧化;参见支持信息S1更详细地讨论可能产生观察到的同位素梯度的机制)。
在属中培养的PB-SRB1 Desulfofustis和Desulfocapsa亲缘关系能够进行硫酸盐还原和元素硫或硫代硫酸盐的歧化(Finster,2008年),证实了我们的同位素发现,这表明歧化可能有助于粉红色浆果硫化物池。生态生理学和基因组数据都强烈支持PB-SRB1能够还原硫酸盐的结论,尽管PB-SRB1使元素硫或硫代硫酸盐歧化的基因组证据仍然不太清楚。尽管最近对测序,但歧化所需的确切基因组仍然未知Desulfocapsa sulfexigens(剂)进行一种不能进行硫酸盐还原的硫歧化了(Finster等人,2013年)。除了亚硫酸盐氧化还原酶(Frederiksen and Finster,硫歧化途径似乎涉及许多用于硫酸盐还原的相同基因,在2003)外,PB-SRB1和D.sulfexigens(Finster等人,2013年)。
在纯培养中,只有在硫化物汇存在的情况下才描述了元素硫歧化的生长,该硫化物汇保持外源硫化物浓度低,为该反应提供热力学有利条件(Canfield等人,1998年;Finster,2008年)。PB-PSB1对硫化物的光养消耗在聚生体中提供了一个生物硫化物汇,可以为元素硫歧化创造一个有吸引力的生态位,具有丰富的硫沉积物和低浓度的硫化物。如果硫化物达到更高的浓度,多硫化物的歧化可能成为PB-SRB1代谢策略的重要组成部分。最近对厌氧甲烷氧化财团的研究表明,至少一些硫酸盐还原财团成员可以通过元素硫与硫化物的非生物反应使硫化环境中形成的二硫化物不成比例(Milucka等,2012)。
结论
追踪在天然微生物群落中驱动微尺度生物地球化学过程的种间代谢交换仍然是一项技术挑战。例如,层状光合微生物垫中的生物地球化学循环已经研究了几十年(例如Canfield和Des Marais,1993年;Decker等人,2005年;Baumgartner等人,2009年;Petroff等人,2011年),但微生物相互作用控制底物通量(Burow等人,2013年)和地球化学特征(Fike和Grotzinger,2008年;Fike等人,2008年)才刚刚开始被理解。使用粉红色浆果,我们展示了如何使用综合微生物学和微地球化学方法来解密在微观尺度上驱动硫循环的微生物代谢伙伴关系。这种方法最终可能用于检查更复杂的生态系统,提供了同养种间硫转移的直接证据。
硫化物丰度和同位素组成空间梯度的SIMS分析为这种微尺度硫循环提供了地球化学背景。我们发现值得注意的是,即使在这个描述充分、多样性有限的系统中,观察到的硫化物同位素变化也可以用许多不同的合理场景来解释,从单独的硫酸盐还原到一系列耦合的还原和氧化过程(另见支持信息S1)。这种模糊性表明,单独使用此类数据重建更复杂的沉积系统(包括古代和现代)中的硫循环时应该小心。虽然我们已经证明了硫循环的一部分(硫酸盐还原和硫化物氧化)的活性,但我们的工作和其他基于硫的同养物(Norlund等人,2009年;Milucka等人,2012年)的数据表明,也可能存在存在一个涉及中间氧化态硫物质(例如元素硫、二硫化物、硫代硫酸盐)的代谢相互作用网络,仍有待探索。
《盐碱地沼泽中的光养粉红色贝类的微量硫循环》——概括 、介绍
 相关新闻
相关新闻