热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
使用离体培养的小鼠的血管纹中间细胞,用记录离体的中间细胞的膜电位的方法,观察顺铂是否能够影响中间细胞上的离子通道和离子泵。
内淋巴电位及胞外电位的测量
动物腹腔注射麻醉剂(氯胺酮90 mg/kg+甲苯噻嗪4.5 mg/kg),麻醉满意后,在隔音屏蔽室内,将动物腹侧向上放置于保温垫上,使其体温维持于37°C。固定头部及四肢。颈部正中皮毛备皮。颈部正中切口,手术显微镜下分离皮下组织及肌肉,做气管切开。进一步分离颈部肌肉组织,并分离听泡表面附着软组织,暴露听泡。充分止血后开放听泡,充分暴露镫骨动脉,耳蜗底转。
内淋巴电位的记录方法在以前发表的文章里已有详细介绍[16-21]。我们选择耳蜗底转来进行内淋巴电位测量。玻璃微电极(直径为1µm,输入阻抗10-20 MΩ)固定于微操纵器上,电极内充满150 mM KCl溶液。参考银球电极埋入同侧颈部肌肉内。使用微操纵器将玻璃微电极由圆窗插入,缓缓推进,电极与耳蜗表面接触时调整记录信号的基线为零。经鼓阶通过穿透基底膜进入中阶(图1A)后,观察到一个稳定的直流电位。使用Axopatch 200B放大器(Molecular Probe,Sunnyvale,CA)来放大电信号(滤过频率为1 kHz)。使用16位A/D转换器进行模数转换。使用pClamp10.0的软件进行信号采集。采样频率设定在10 kHz。
通常采用圆窗电极的方法记录微音电位[18-21]。我们采用插入鼓阶中记录内淋巴电位的微电极记录胞外电位(即微音电位)。记录胞外电位时,我们采用4kHz的短纯音,升降时间为0.1ms,时程1秒,强度为85dBSPL。声音由信号发生器产生,经放大后由扬声器(MF1-S,TDT)给出。在记录胞外电位时,用Axopatch 200B放大器放大信号,滤过频率为10kHz,采样频率为50kHz。
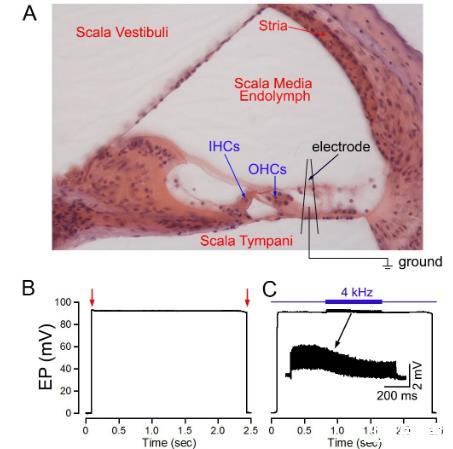
图1记录成年小鼠耳蜗EPFig.1 Recording EP from adult mouse cochleaeA:使用微电极通过耳蜗基底膜记录内淋巴电位(EP)的示意图。IHC:内毛细胞;OHCs:外毛细胞。B:从小鼠耳蜗底转记录到的内淋巴电位,红色箭头所指为电极插入、退出中阶的时间点。C:从小鼠耳蜗底转记录到的内淋巴电位和胞外电位。在记录内淋巴电位过程中,用4kHz的短纯音诱发胞外电位(即耳蜗微音电位)。放大的胞外电位显示在图C的插图中。
中间细胞培养
将生后5天C57BL/6J小鼠的内耳组织取出,分离出耳蜗中转、顶转的血管纹。将分离获得的血管纹组织放入预先准备好的装有DMEM的培养皿中,然后铺平将其放入到培养箱中。两个小时后加入少量胎牛血清使其浓度达到5-10%之间。次日早晨将培养皿中的培养基更换成PVM细胞专用培养基。在培养过程中,中间细胞会从血管纹中迁移出来,培养5-7天后,大部分中间细胞已经迁移出血管纹。由于其含有色素,中间细胞非常易于辨认。
使用全细胞膜片钳记录细胞静息电位
使用Olympus BX51WI正置显微镜和Axo⁃patch 200B放大器,来进行全细胞电压/电流钳记录。微电极使用3D的微操纵器来控制(MHW-3,Narishige,日本)。微电极是使用显微拉制仪从直径1.5 mm玻璃管(A-M Systems,Carlsborg公司)拉制而成。记录电极的电阻为3-4 MΩ,内充的溶液的成分(mM)为150 KCl,2 MgCl2,1 EGTA,10 HEPES,使用KOH将pH调节到7.3。全细胞膜片钳建立好后,整个通路的串联电阻为8-12 MΩ。