热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
日辐射和环境因素
在研究期间(2007年6月20日至7月20日),海湾的每日大气太阳辐照度范围为3至33摩尔光子m-2 d-1(附录2A)。根据估计的光衰减系数,EG1和EG2的鳗草冠层深度处的表面辐照度降低至约8-12%,富含生物量的大型藻类站点(AG)处的表面辐照度降低至约15-32%。浅层沉积物(泥草层底部)的辐照度为表面辐照度的5-8%(附录2B),而在深层未植被沉积场地(UNV),只有1%的表面辐照度到达沉积物表面。相比之下,水温和盐度相对一致,分别在20至25°C和S=32.2至32.5之间。研究期间的平均风速为1.27 m s-1。
鳗草和大型藻类生物量
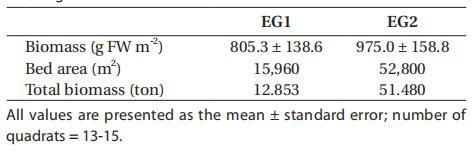
在鳗草床EG1,估计地上鳗草生物量为805.3±138.6 g FW m-2。2007年6月,预计鳗草覆盖面积和总生物量分别约为15960 m2和13湿吨(表1)。在eelgrass河床EG2,平均地上eelgrass生物量估计为975.0±158.8 g FW m-2,eelgrass覆盖面积和总生物量估计分别约为52800 m2和51湿吨。
表1:2007年6月,两个鹅草床的地上生物量、床面积和总生物量
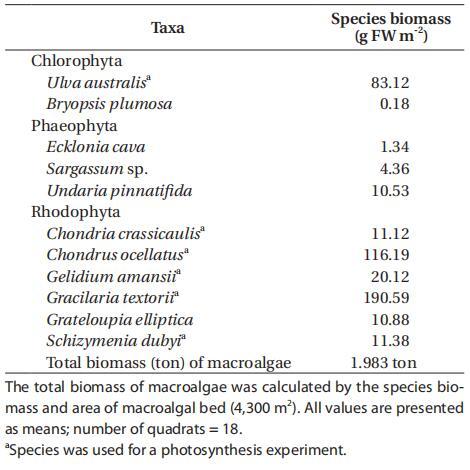
在大型藻类植被现场(AG),沿潮下岩岸分布着11种大型藻类,其中2种为绿藻,3种为褐藻,6种为红藻(表2)。其中,6个物种(Ulva australis、Gelidium amansii、Gracilaria textorii、Schizymenia dubyi、Chondria crasicaulis和Chondrus ocellatus)占大型藻类总生物量的91%,在4300 m2的大型藻类植被面积中约占2湿吨。一半以上的大型藻类生物量(64%)分布在浅海潮下带区域(约2米深),81%的生物量分布在水深<4米的区域。在绿藻中,澳大利亚U.australis的个体生物量最高(平均83.12克FW m-2,范围从0到627.47克FW m-2),占大型藻类总生物量的18%,主要分布在上海岸带。其中两种红藻,克氏丝藻和短尾丝藻的生物量比其他物种高得多,克氏丝藻的生物量介于0到1320.69克FW m-2(平均190.59克FW m-2)之间,短尾丝藻的生物量介于0到1012.66克FW m-2(平均116.19克FW m-2)之间,分别占大型藻类总生物量的41%和25%(表2)。
表2:2007年6月潮下岩岸主要大型藻类种类及其平均生物量
植被(鳗草和大型藻类)和微生物群落(浮游植物和微生物垫)的生产力和呼吸
鳗草和大型藻类的光合作用各不相同,P-I曲线的光合参数清楚地确定了其特征(附录3A-E)。具体而言,鳗草的最大光合速率(PB max)、光合效率(α)和饱和辐照度(Ek)分别为3.28±0.21 mg C g-1 FW h-1、0.008±0.000 mg C g-1 FW h-1/µmol光子m-2 s-1和241±46µmol光子m-2 s-1(表3)。对于大型藻类而言,澳大利亚紫苏的PB最大值最高(8.31±0.87 mg C g-1 FW h-1),呼吸速率最高(Rd=0.46±0.04 mg C g-1 FW h-1)。五种红藻(占大型藻类总生物量的78%)的PB最大值均较低,范围为0.54至2.45 mg C g-1 FW h-1,比澳大利亚红藻低70-93%。此外,观察到的最高α值为澳大利亚U.australis(0.032±0.008 mg C g-1 FW h-1/µmol光子m-2 s-1),是其他大型藻类物种的2-10倍。其他红藻的α和Rd较低,与绿藻和鳗草相当,α的变化范围为0.003至0.017,而Rd.Z.marina、C.crassicaulis和g.amansii的Ek较高,超过200µmol光子m-2 s-1。鳗草和大多数大型藻类都表现出光抑制的光合特性,除厚壳锦鸡儿外,其光照强度大于饱和光照强度。光抑制程度因物种而异,在强光强度下,棉铃虫表现出最高的光抑制(总光合作用几乎得到补偿)。
表3:。根据P-I曲线拟合计算的每个物种或群落的光合参数(Platt et al.1980):最大光合速率(PB max)、光合效率(α)、饱和辐照度(Ek)和暗呼吸(Rd)或群落呼吸(CR)
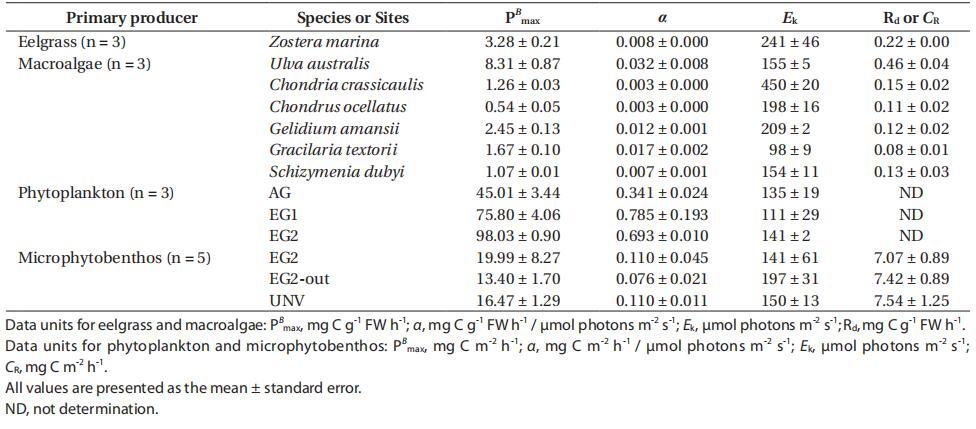
浮游植物的光合特性因植被类型的不同而明显不同,但微生物群落的光合特性与生境类型的差异不显着(附录3H&I)。在鳗草层中观察到浮游植物的面积PB max和α较高,鳗草层(EG1和EG2)的PB max和α平均比AG高93%,α平均高117%。三个栖息地浮游植物组合的Ek值范围为111至141µmol光子m-2 s-1,这些值在植被类型之间没有太大差异。微细胞底栖生物的面积PB max的光合参数在鳗草层最高(EG2,19.99±8.27 mg C m-2 h-1),在鳗草层外侧最低(EG2 out,13.40±1.70 mg C m-2 h-1)。鳗草层中微细胞底栖动物的α与深层沉积生境中的α相似(平均值为0.110 mg C m-2 h-1/µmol光子m-2 h-1),该值比鳗草层外的值(EG2 out)高44%。无论栖息地类型如何,微型底栖生物的Ek范围为141至197µmol光子m-2 s-1。此外,包括在微型底栖生物和微生物呼吸中的沉积物呼吸,在栖息地类型之间没有显示出很大的差异,范围为7.07-7.54 mg C m-2 h-1。总之,优势大型植物和微生物群落的光合作用和呼吸作用是评估群落和生态系统产量的重要因素。
社区/生态系统生产和NEE
植被群落的GCP较高,但高呼吸速率是植被系统高GCP的潜在抵消因子。具体而言,与微藻群落(浮游植物和微型底栖生物)相比,鳗草类和大型藻类群落表现出极高的NCP和GCP(图2)。此外,在EG1和EG2中,鹅草床的GCP分别为6.51±0.67和5.70±0.62 g C m-2 d-1,鹅草的NCP分别占EG1和EG2 GCP的35%和10%。大型藻类植被(AG)的NCP占GCP的63%,GCP和NCP值分别为4.83和3.05 g C m-2 d-1。远洋浮游植物群落是一个净自养系统(平均值为0.288 g C m-2 d-1),而无论群落类型如何,底栖微生物垫都显示出净异养群落(平均值为-0.156 g C m-2 d-1)。
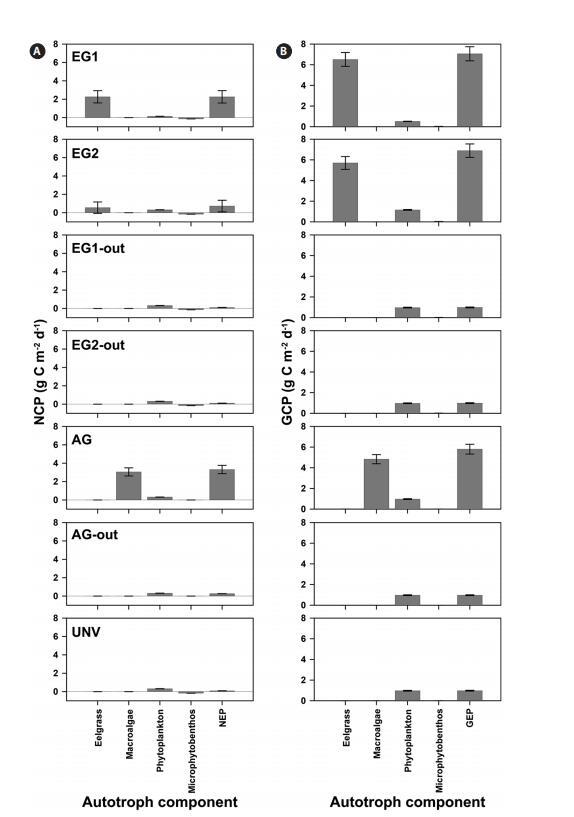
图2:。2007年6月20日至7月20日(31天),七个地点自养生物的平均每日净群落生产量(NCP)(A)和每日总群落生产量(GCP)(B)。每日净生态系统生产量(NEP)和总生态系统生产量(GEP)通过沿自养生物组成的NCP和GCP积分计算。所有值均表示为平均值±标准误差。
植被系统中GCP和NCP的高比率也导致NEP和GEP值较高(图2)。根据NEP和P:R比率(GEP与生态系统呼吸,Re),所有研究地点均显示净自养生态系统,NEP为0.09-3.31 g C m-2 d-1,P:R比率为1.10-2.33(表4,图2)。由于鳗草的生产力和生物量较高,因此,鳗草栖息地的GEP最高(EG1,7.06±0.68 g C m-2 d-1)。否则,在未植被覆盖的岩石海岸(AG out,0.97±0.04 g C m-2 d-1)观察到最低的GEP,其中仅考虑了浮游植物产量。银的NEP最高(3.31±0.45 g C m-2 d-1),P:R比最高(2.33)。此外,与GEP相比,鹅草床的NEP(EG1和EG2中分别为2.26±0.67和0.73±0.63 g C m-2 d-1)降低了约78%,即使这些地点由于生态系统的高呼吸而显示出最高的GCP。
表4:。每月生态系统总产量:每个研究地点的生态系统呼吸(Re)比率(2007年6月20日至7月20日)

根据海水CO2交换测量(NEE)的结果,具有高GEP和密集eelgrass的eelgrass层(EG1和EG2)充当CO2汇(EG1和EG2分别为-0.81±0.17和-0.45±0.09 mg C m-2 d-1)。此外,尽管NEP低于植被系统中的NEP(-0.34±0.07 mg C m-2 d-1),EG1 out仍充当CO2汇。其他未种植场地(EG1外除外)作为CO2源,其结果范围为0.20至2.32 mg C m-2 d-1(图3)。否则,即使该系统以高产区(1.66±0.34 mg C m-2 d-1)为特征,银也可作为大气的CO2源。
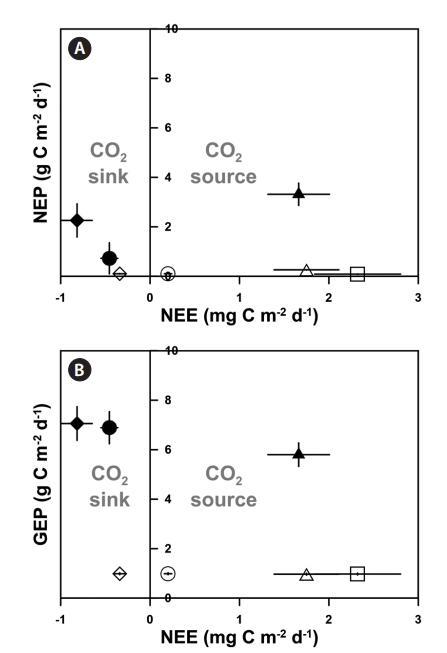
图3:。两个鹅草床的净生态系统产量(NEP)(A)和总生态系统产量(GEP)(B)与海气界面CO2交换(净生态系统交换,NEE)的比较(◆,EG1;●,EG2),大型藻床(▲,AG),浅层沉积区(◇,EG1输出;○,EG2 out),深层沉积区(□),和深部岩石区域(△,2007年6月20日至7月20日(31天)。所有值均表示为平均值±标准误差。
沿海碳循环的概念模型
沿海碳循环的概念图,将生态系统生产和NEE沿着各种类型的亚生态系统进行,如图4所示,在局部方格范围内(约30 km2)。整个光洋湾系统通过GEP共吸收41.4吨无机碳,并通过Re向沿海水域释放35.1吨CO2(图4A)。具体而言,深部沉积区的GEP最高,为18.0吨C d-1。尽管鳗草床只占据了一小部分区域,但与深层沉积栖息地(13.3吨C d-1)相比,该系统占海湾局部箱型规模GEP的73%。大型藻类植被的GEP、NEP和Re最低(分别为0.6、0.3和0.2吨C d-1),可能是因为大型藻类栖息地占据了海湾面积的最小比例。在亚生态系统中,鹅草床的NEP最高(2.8吨C d-1)。因此,这个海湾系统大约有6吨碳,根据NEP可能被固定为有机物,部分光合有机碳可能被隔离到外海。此外,据NEE估计,约47千克CO2从海水排放到大气中。
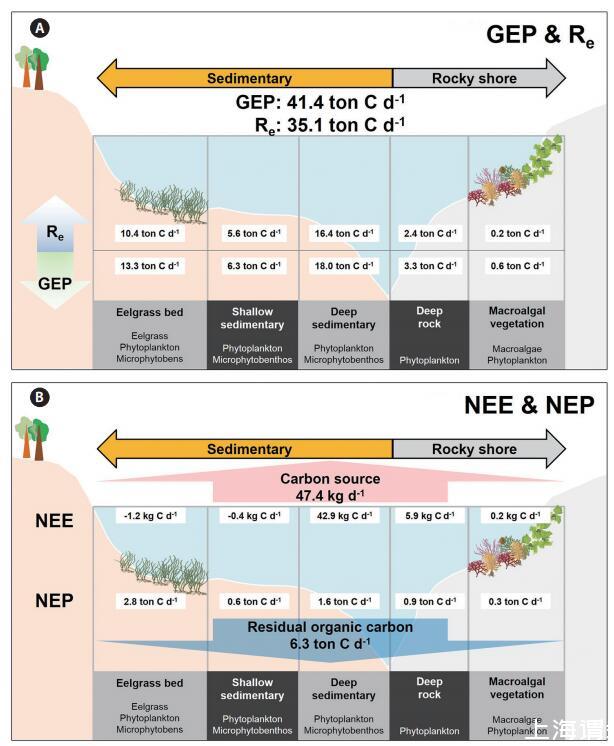
图4:。光阳湾东北部沿海初级生产者驱动的碳通量概念图(30 km2)。2007年6月20日至7月20日(31天)期间,不同植被/非植被系统的每日生态系统总产量(GEP)和Re(A)、净生态系统产量(NEP)和净生态系统交换(NEE)(B)的平均值。
尽管许多研究试图描述沿海碳循环,但量化植被沿海生态系统中的碳收支仍然存在局限性,还需要进一步努力(Tokoro et al.2014)。例如,一些研究侧重于基于气体交换和NCP的生态系统生产中的生物代谢和碳质量平衡方法(Bates et al.1998,Sarma 2003)。此外,通过比较河口系统的净生态系统产量和气体交换,估算了碳通量(Pradeep Ram et al.2003)。然而,这些研究主要局限于仅考虑浮游植物和/或微型底栖生物的非植被地区。此外,一些研究侧重于生物代谢,以估计营养海岸栖息地的碳平衡。因此,通过测量初级生产力,估算了以植被为主的栖息地的碳收支。然而,这些研究没有考虑许多复杂的碳参数,例如与大气的气体交换(Frankignoule和Bouquegneau 1987,Kaldy et al.2002)。为了解决这些不足,我们进行了调查,以建立沿海碳通量的概念箱模型,并关注基于生态系统生产和各种类型植被和非植被系统中CO2气体交换的碳质量平衡。
沿海植被生态系统通常被描述为高产区,我们的生产/呼吸数据支持这一点。我们研究中的所有亚生态系统在性质上都是自养的(即P:R比率>1)(表4),生产:呼吸比率与其他研究中发现的相当(例如,海草床,1.19-1.50;非植被生境,0.03-34.3)(Duarte和Agusti 1998,Ziegler和Benner 1998)。虽然光阳湾在实验期间是一个生产力充足的环境,如P:R比率所示,但并非每个亚生态系统都能充当大气中的CO2汇。这并不奇怪,因为许多具有强烈生物地球化学活动的沿海生态系统可以作为大气的CO2源(Borges等人,2005年)。我们的NEE结果表明,根据现有植被的类型,植被茂盛的海湾可以同时作为CO2的汇和源(图3)。具体而言,我们的两个鳗草床充当CO2汇,可能是因为鳗草的高光合活性和近乎停滞的海水。这些环境特征可能会导致表层海水中pCO2的减少,从而破坏鳗草床内外的海水混合(Madsen et al.2001)。这些特征也发生在我们的非植被地区。具体而言,浅层沉积场地(EG out)的CO2交换速率适中;然而,高能岩石海岸(AG场地)和深海岸沉积场地(AG out和UNV)是大气的CO2源。与鹅草床相反,由于水平和垂直湍流漩涡和混合,这些栖息地可能导致无机碳从栖息地迁移出去(Madsen et al.2001)。因此,即使大型藻类从周围海水中吸收大量无机碳,这些栖息地海水中的pCO2可能不会减少。因此,NEE的特点是海岸环境的复杂特征,如海水运动和自养生物生产力减少的陆地有机物流入。
沿海生态系统中的NEP(中上层和底栖NCP的整合)是与向沿海系统以外区域输出碳相关的一个关键因素(Duarte et al.2005),在碳封存方面尤为重要,因为大量输出的碳可以转移到公海或埋在沉积物中。尤其是,沉水水生植被显示出显着的高生态系统产量(Kaldy et al.2002)。因此,在调节碳循环方面,底栖自养生物的生产是沿海生态系统的一个重要组成部分,它可以提高有机碳固存效率(Mcleod et al.2011)。用五种类型的海岸亚生态系统(鹅草层、大型藻类植被、浅层沉积、深层沉积和深层岩石)划分的区域NEP代替,构建了当地海岸系统碳通量的概念图(见图4)。当地盒状比例尺(30 km2;光洋湾东北部)的估计NEP值约为6.3吨C d-1,可表示为有机碳质量平衡(图4A)。特别是,植被栖息地(鳗草和大型藻类床)的NEP在整个研究场地(30 km2)中显示出33%的GEP,尽管这些栖息地仅占总面积的12%。如果植被覆盖的沿海生态系统产生超负荷的光合作用有机碳,可能会导致碳固存率增加(Barrón等人,2003年)。有两条重要途径可以了解沿海海洋中固定有机碳的去向(Ver等人,1999年)。一部分出口碳将1)运输到公海(溶解和/或颗粒有机碳),或2)埋在沉积物中。沉积物上层的有机碎屑可能影响营养物质的氧化和循环(Giusti和Marsili Libelli 2005),并通过“大陆架泵机制”出口到边缘海(Tsunogai et al.1999)。然而,我们的研究没有通过这两条途径对植被海岸生态系统中的有机碳循环进行量化,因此这些因素仍然是未来研究的主题,以澄清海岸有机碳循环。碳排放的另一个次要途径是排放到大气中。我们的NEE结果量化了排放到大气中的CO2,并表明我们当地沿海地区排放到大气中的CO2约为47.4 kg d-1,约为NEP的200倍。与生态系统生产相比,这一水平很低,但大气-海水界面的CO2气体交换尚未就各种植被系统的生态系统生产进行探索。
这项研究确实意义非凡,因为考虑了许多与海岸碳通量有关的可测量参数,如生物量、各种海岸自养生物的生产力以及与原位光剖面的CO2交换。然而,由于与调查相关的困难,本研究未反映时空因素。例如,为了了解植被海湾系统中的沿海碳通量,仍然需要澄清内陆的碳输入源以及植被现存作物和生产力的异质性,但这些参数受到不同时空尺度的高度影响(Randerson et al.2002)。特别是,NEP的调节高度依赖于初级生产总值和生态系统生产,具有月度时间尺度和区域空间尺度的研究,但河流碳输出的优先级相对较低。虽然本研究在有限的时空尺度上进行,但应考虑河流碳输入源,以在一定的时空尺度上完善植物湾系统内的整体概念碳通量模型。此外,目标研究区域的潮汐周期幅度较高,因此,由于光照强度和微藻丰度高度依赖于该因素,因此它对沿海自养生物的生产力有着至关重要的影响。我们不能将复杂的潮汐周期应用于海岸碳循环的概念模型设计,这应该通过未来的研究加以澄清。
总之,本研究提供了一个如何使用质量平衡方法将复杂海岸植被系统中的碳通量估算与光合作用和CO2气体交换测量相结合的示例。基于我们的结果,我们使用提出的模型对海湾生态系统中的碳通量进行了短期量化。虽然我们的概念箱模型没有考虑所有复杂的生物活动和环境波动,但它足以评估碳通量的短期和局部尺度估计。此外,我们提出了一个概念性的盒子模型,可应用于其他植被系统,以估算沿海碳循环。为了实现这一目标,需要考虑有关海水中碳化学的其他参数。其中包括溶解无机碳、颗粒/溶解有机碳的去向,以及长期和大空间尺度的水文参数和碳矿化。
确认书
作者感谢Tae Seob Choi和Seung Gu Shin的现场协助和调查。这项工作得到了KIMST/MOF向KYK资助的“造成生态干扰和有害影响的海洋生物管理”项目的支持。