热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
将UCNPs与四甲基罗丹明(TAMRA)标记的ATP适配体(cATP),组成荧光共振能量转移(FRET)体系,以碲化镉量子点(CdTe QDs)作为光电活性材料,共同修饰于微电极表面,构建可近红外激发的ATP光电化学微传感器。该PEC微传感器已成功应用于药物诱导的炎症小鼠模型中脑内ATP的活体原位检测。
FRET调控光电流信号的可行性
将光电材料和UCNPs组成的荧光探针依次修饰到微电极上,并测试了不同修饰电极的光电流响应。由于CdTe QDs-MWCNTs在980 nm波长处的吸收很弱,因此在980 nm的近红外光的激发下,只有CdTe QDs-MWCNTs修饰微电极表现出微小的光电流信号(图1曲线a)。当CdTe QDs-MWCNTs和UCNPs共同修饰到微电极表面后,UCNPs/CdTe QDs-MWCNTs/微电极在含有200μmol/L AA的aCSF中表现出最强的光电流信号,为315.2 nA(图1曲线b),说明UCNPs的发光能够有效激发CdTe QDs并产生光电流信号。修饰cDNA后,cDNA/UCNPs/CdTe QDs-MWCNTs/微电极的光电流略微减小,为285.3 nA(图1曲线c),表明cDNA在电极表面的成功修饰。将TAMRA-cATP修饰到UCNPs后,由于TAMRA对UCNPs发光的猝灭作用,TAMRA-cATP/cDNA/UCNPs/CdTe QDs-MWCNTs/微电极的光电流显著降低,为91.3 nA(图1曲线d)。TAMRA-cATP/cDNA/UCNPs/CdTe QDs-MWCNTs/微电极与ATP(80 nmol/L)反应后,光电流明显增强,为185.5 nA(图1曲线e)。以上实验结果表明,ATP与适配体之间的特异性结合能够引起光电流信号的改变。
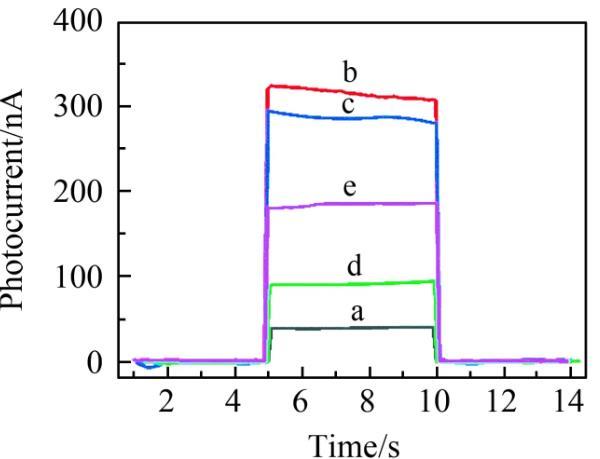
图1不同修饰电极的光电流大小:(a)CdTe QDs-MWCNTs/微电极;(b)UCNPs/CdTe QDs-MWCNTs/微电极;(c)cDNA/UCNPs/CdTe QDs-MWCNTs/微电极;(d)TAMRA-cATP/cDNA/UCNPs/CdTe QDs-MWCNTs/微电极;(e)TAMRA-cATP/cDNA/UCNPs/CdTe QDs-MWCNTs/微电极与ATP反应后
传感器对ATP的响应研究
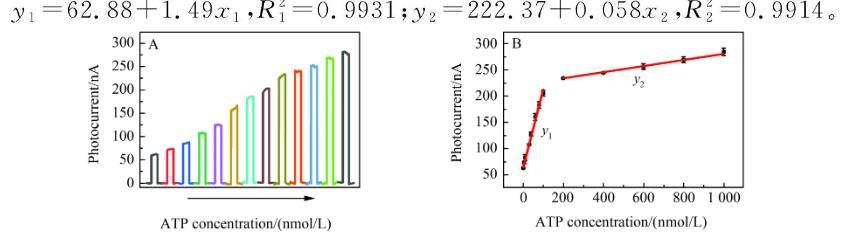
图2(A)微传感器与不同标准浓度ATP反应后的光电流响应;(B)光电流大小与ATP浓度之间的线性关系
传感器的选择性研究
由于活体环境复杂,传感器的选择性对活体分析十分重要。因此,我们考察了活体生物环境中共存的一些结构类似物、阴阳离子和氨基酸等物质对微传感器的影响。共存物质对微传感器的光电流信号基本没有影响或者影响较小,当加入ATP时,光电流显著增加,说明该微传感器对ATP具有很高的特异性。
LPS的注射量对ATP含量的影响
LPS是一种常见的内毒素,可以诱导小鼠全身性炎症,我们通过腹腔注射LPS建立小鼠全身性炎症模型,并用制备的微电极活体原位检测小鼠脑内细胞间质中ATP的水平变化。我们首先研究了不同LPS注射量对小鼠皮质内ATP水平的影响。腹腔分别注射3 mg/kg、5 mg/kg、7 mg/kg时,光电流分别为35.1 nA、47.0 nA、59.1 nA。相比于对照组(0 mg/kg)光电流信号分别增加了95.0%、161.1%、228.3%。实验结果表明LPS诱导的炎症会引起脑内ATP水平的显著升高,并且ATP水平会随着LPS浓度的增加而进一步升高,说明大脑向胞外释放ATP是应对炎症的方式之一。
2.8炎症时间对ATP浓度的影响研究
我们将制备的微电极用于LPS诱导的全身炎症小鼠模型中,活体原位检测不同时间点脑内ATP的含量变化,研究了药物诱导时间与脑内细胞间质中ATP水平变化的关系。在2~6 h内,光电流信号随着LPS注射时间的增加而增大,在LPS注射6 h时,光电流信号达到峰值(47.2 nA),之后(6~24 h内)基本保持不变。实验结果表明:LPS诱导的炎症会引起脑内ATP含量的增加,并且随着药物诱导时间的推移,ATP的释放进一步增加,在6 h后达到峰值,并且在24 h内一直维持在高位,说明炎症持续时间较长。