热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
结果
葡萄浆果的内部氧分布
在霞多丽中,[O 2]从表皮向中果皮内部减少,在2.2-4毫米深度处达到低浓度(图1)。该的最小[O 2深度范围内]为5.5±5.5µmol l–1。然而,随着进一步向浆果中心轴渗透,[O 2]增加并在7毫米深度处达到最大值(图1)。为了测试[O 2]分布是否受到引入的O影响,2的通过渗透部位N 2在测量过程中将气体轻轻施加到传感器的入口点。的[O 2对照和氮处理浆果]分布相似(图1),表明通过渗透部位的泄漏不会影响记录的分布。
成熟过程中内部氧谱的变化和细胞死亡的进展
为了揭示CD的进展与浆果内缺氧之间是否存在联系,我们使用FDA染色确定了CD,并记录[O 2了同一天采样的浆果的]剖面。类似的[O 2 Chardonnay和Ruby Seedless(中观察到]分布图2A、C)以及Shiraz在前1.5毫米(图2E),但,[O 2随着成熟的进行]在整个果皮上下降得更陡峭在所有品种中,导致整个[O总体较低2浆果的]。这表现为最低[O低得多2最后成熟阶段采样的]:霞多丽0µmol l–1、红宝石无籽14.9±8.86µmol l–1和设拉子0µmol l–1。由于无法在设拉子浆果中看到种子,因此微型氧传感器无法移入浆果中超过约1.6毫米,而不会危及传感器的完整性(图2E)。然而,很明显,[O 2]急剧下降到1毫米(图2E)。
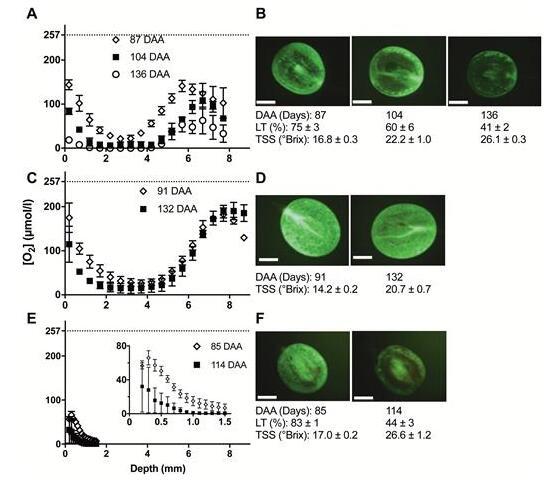
图2
[O2]霞多丽、红宝石无核和设拉子浆果(A、C、E)在不同成熟阶段的[O2]剖面图以及每个品种(B、D、F)果皮中活组织(LT)的相应示例。(A)霞多丽浆果在2015-2016季节的DAA为87、104和136时采样。双向方差分析(重复)显示,深度占总变异的46.7%(P<0.0001),时间占总变异的29.9%(P<0.0001),交互作用占总变异的8.0%(P=0.058))。水平虚线表示室温下Millipore水的近似O2饱和值,与测量时的浆果相同。(B)用FDA染色的内侧纵向切片(霞多丽),突出了不同成熟阶段的LT差异(对应于A)。(C)2016-2017季节在91和132 DAA下采样的Ruby无核浆果的[O2]配置文件。双向方差分析(重复)显示深度占总变异的85.2%(P<0.0001),时间占总变异的1.2%(P=0.0025),交互作用占总变异的3.7%(P=0.048))。(D)Ruby Seedless的LT在两个相应的采样日接近100%。(E)2014-2015季节在85和114 DAA上采样的设拉子浆果的[O2]配置文件。插图显示了1.5毫米的轮廓细节。双向方差分析(重复)显示,深度占总变异的40.9%(P=0.0005),时间占总变异的19.6%(P<0.0001),交互作用占总变异的6.4%(P=0.43))。(F)设拉子的LT。数据是平均值±SE,对于(A)、(C)和(E),n=3。
[O 2]霞多丽、红宝石无核和设拉子浆果(A、C、E)在不同成熟阶段的概况以及每个品种(B、D、F)果皮中活组织(LT)的相应示例。(A)霞多丽浆果在2015-2016季节的DAA为87、104和136时采样。双向方差分析(重复)显示,深度占总变异的46.7%(P<0.0001),时间占总变异的29.9%(P<0.0001),交互作用占总变异的8.0%(P=0.058)。水平虚线表示的近似O 2室温下Millipore水饱和值,与测量时的浆果相同。(B)用FDA染色的内侧纵向切片(霞多丽),突出了不同成熟阶段的LT差异(对应于A)。(C)[O 2 2016-2017季节在91和132 DAA下采样的红宝石无核浆果的]概况。双向方差分析(重复)显示深度占总变异的85.2%(P<0.0001),时间占总变异的1.2%(P=0.0025),交互作用占总变异的3.7%(P=0.048)。(D)Ruby Seedless的LT在两个相应的采样日接近100%。(E)[O 2 2014-2015季节在85和114 DAA上采样的设拉子浆果的]概况。插图显示了1.5毫米的轮廓细节。双向方差分析(重复)显示深度占总变异的40.9%(P=0.0005),时间占总变异的19.6%(P<0.0001),交互作用占总变异的6.4%(P=0.43)。(F)设拉子的LT。数据是平均值±SE,,n对于(A)、(C)和(E)=3。
[O2]霞多丽、红宝石无核和设拉子浆果(A、C、E)在不同成熟阶段的[O2]剖面图以及每个品种(B、D、F)果皮中活组织(LT)的相应示例。(A)霞多丽浆果在2015-2016季节的DAA为87、104和136时采样。双向方差分析(重复)显示,深度占总变异的46.7%(P<0.0001),时间占总变异的29.9%(P<0.0001),交互作用占总变异的8.0%(P=0.058))。水平虚线表示室温下Millipore水的近似O2饱和值,与测量时的浆果相同。(B)用FDA染色的内侧纵向切片(霞多丽),突出了不同成熟阶段的LT差异(对应于A)。(C)2016-2017季节在91和132 DAA下采样的Ruby无核浆果的[O2]配置文件。双向方差分析(重复)显示深度占总变异的85.2%(P<0.0001),时间占总变异的1.2%(P=0.0025),交互作用占总变异的3.7%(P=0.048))。(D)Ruby Seedless的LT在两个相应的采样日接近100%。(E)2014-2015季节在85和114 DAA上采样的设拉子浆果的[O2]配置文件。插图显示了1.5毫米的轮廓细节。双向方差分析(重复)显示,深度占总变异的40.9%(P=0.0005),时间占总变异的19.6%(P<0.0001),交互作用占总变异的6.4%(P=0.43))。(F)设拉子的LT。数据是平均值±SE,对于(A)、(C)和(E),n=3。
活力染色(图2B、F)表明,对于霞多丽和设拉子,CD随着TSS的积累而随时间增加,并且主要发生在中果皮的中部,对应于[O的最小值2]中。此外,霞多丽浆果赤道处荧光信号强度的变化显示出与浆果内部[O相似的趋势2](图3A 3A),表明细胞活力与内部[O)之间存在相关性2](图。3B)。另一方面,当TSS为20.7°Brix时,Ruby Seedless浆果在132 DAA下保持接近100%的细胞活力(图2D)。虽然类似形状的[O 2与霞多丽浆果的中果皮相比,在Ruby Seedless浆果的中果皮中观察到]分布(图图2C),但[O 2]没有达到零。
图3
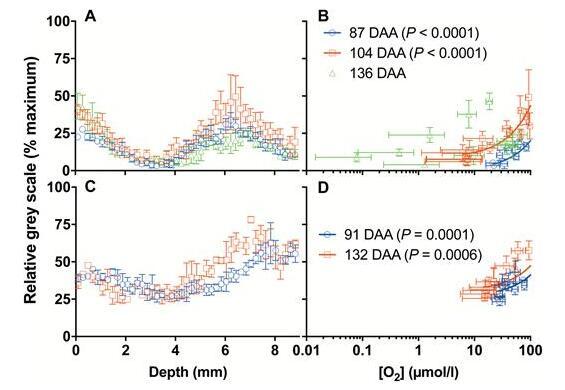
活组织荧光信号与[O2]分布之间的相关性。来自霞多丽(A)和Ruby Seedless(C)赤道半径上的FDA染色(高值=较高的活组织)的荧光信号[相对灰度(%最大值)]。87和104 DAA上的霞多丽(B)和91和132 DAA(D)上的Ruby Seedless中相应深度(对数刻度)的荧光信号强度和[O2]之间的相关性(戴明回归)([O2]分布如图2所示)。1)。数据是平均值±SE,n=3。
活组织荧光信号与[O之间的相关性2]分布。来自霞多丽(A)和Ruby Seedless(C)赤道半径上的FDA染色(高值=较高的活组织)的荧光信号[相对灰度(%最大值)]。荧光信号强度与[O之间的相关性(戴明回归)2 87和104 DAA上的霞多丽(B)和91和132 DAA上的Ruby Seedless(D)中相应深度(对数刻度)处的]([O 2]分布如图所示)图1)。数据是平均值±SE,n=3。
活组织荧光信号与[O2]分布之间的相关性。来自霞多丽(A)和Ruby Seedless(C)赤道半径上的FDA染色(高值=较高的活组织)的荧光信号[相对灰度(%最大值)]。87和104 DAA上的霞多丽(B)和91和132 DAA(D)上的Ruby Seedless中相应深度(对数刻度)的荧光信号强度和[O2]之间的相关性(戴明回归)([O2]分布如图2所示)。1)。数据是平均值±SE,n=3。
尽管[O减少2在成熟过程中整个中果皮的],对于霞多丽和红宝石无核浆果,[O 2]开始随着深度从~4.2毫米增加,并在霞多丽中达到最大~6.2毫米,在较大的中达到8.2毫米红宝石无核浆果(图2A、C)。相对于每个浆果复制品(的直径标准化传感器的位置图4 4)表明,)的,[O 2在霞多丽(所有采样时间]在中央维管束区域达到峰值图4A)和Ruby Seedless(图。4B)。
图4
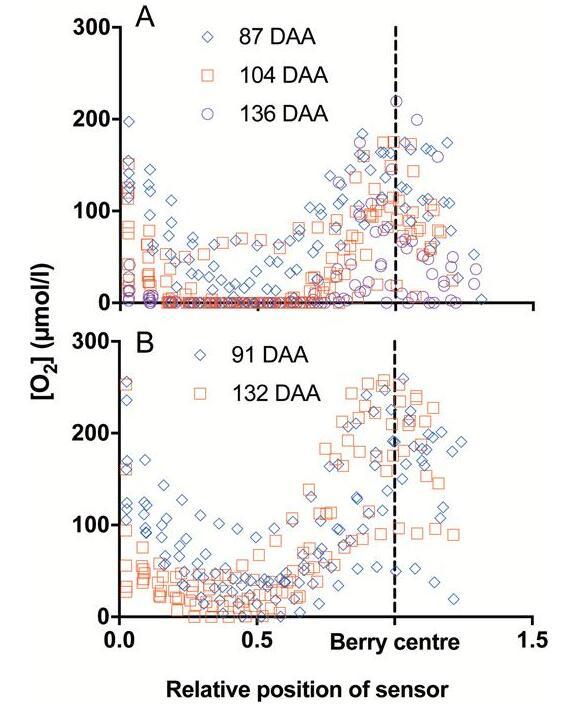
单个浆果[O2]配置文件归一化为浆果半径。(A)2015-2016季节在87、104和136 DAA采样的霞多丽浆果的[O2]分布(平均数据如图2所示)。(B)2016-2017季节在91和132 DAA下采样的单个Ruby无核浆果的[O2]配置文件。
单个浆果[O 2]配置文件归一化到浆果半径。(A)[O 2 2015-2016季节在87、104和136 DAA采样的霞多丽浆果的]分布(平均数据如图所示图2)。(B)[O 2 2016-2017季节在91和132 DAA下采样的单个红宝石无核浆果的]概况。
单个浆果[O2]配置文件归一化为浆果半径。(A)2015-2016季节在87、104和136 DAA采样的霞多丽浆果的[O2]分布(平均数据如图2所示)。(B)2016-2017季节在91和132 DAA下采样的单个Ruby无核浆果的[O2]配置文件。
葡萄浆果内氧气的消耗和供应途径
考虑到CD和[O之间的联系2](图3),以及发育良好的Ruby Seedless浆果中缺乏CD(图2D),我们研究了种子对霞多丽浆果呼吸需求的贡献.种子鲜重在糖分积累和皮肤着色开始时达到峰值,此阶段称为veraison(Ristic和Iland,2005年多丽达),这里的霞到~63 DAA。按每克鲜重计算,此阶段的种子呼吸比整个浆果的呼吸高5倍。与63 DAA相比,122 DAA的浆果呼吸减少了约三分之一(图5A);然而,种子呼吸减少了40倍(图5B)。浆果质量几乎翻了一番,从63 DAA时的7.2±0.5 g到122 DAA时的13.9±1.4 g;因此,在每个浆果的基础上,呼吸速率从63 DAA增加到122 DAA,增加了约18%(图5C)。浆果中种子总数的贡献占veraison浆果呼吸需求的一半以上。这在122 DAA时下降到一个微不足道的比例(图5C)。
图5
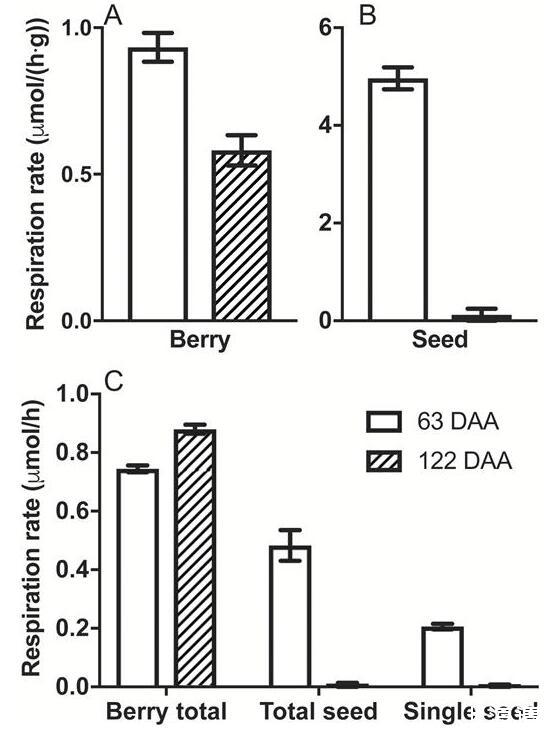
2015-2016季节在63和122 DAA下的霞多丽浆果和种子呼吸(25°C)。浆果(A)和种子(B)以每克鲜重为基础的呼吸作用。(C)基于每个浆果(包括种子)、总种子基础和单种子基础的呼吸速率比较。数据是平均值±SE,n=3。所有比率在63和122 DAA之间都不同(t检验,P<0.05)。
2015-2016季节在63和122 DAA下的霞多丽浆果和种子呼吸(25°C)。浆果(A)和种子(B)以每克鲜重为基础的呼吸作用。(C)基于每个浆果(包括种子)、总种子基础和单种子基础的呼吸速率比较。数据是平均值±SE,n=3。所有比率在63和122 DAA之间都不同(t检验,P<0.05)。
2015-2016季节在63和122 DAA下的霞多丽浆果和种子呼吸(25°C)。浆果(A)和种子(B)以每克鲜重为基础的呼吸作用。(C)基于每个浆果(包括种子)、总种子基础和单种子基础的呼吸速率比较。数据是平均值±SE,n=3。所有比率在63和122 DAA之间都不同(t检验,P<0.05)。
扩散到浆果中的阻力差异可能会影响[O 2]分布。花梗皮孔可能提供O的途径,2进入这可以解释朝向浆果中心轴的较高浓度。Chardonnay(之间的皮孔形态存在明显差异图6A)和Shiraz浆果(图6B)。与设拉子浆果相比,霞多丽花梗上的单个皮孔更大,总表面积占花梗表面积的比例也大10倍(图6C)。
图6。
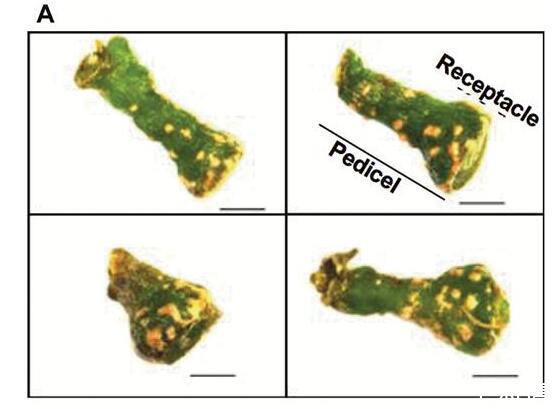
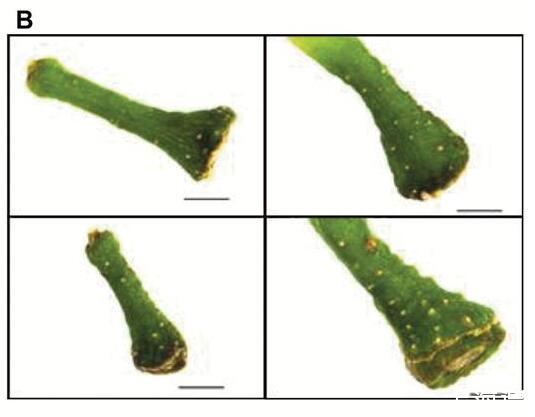
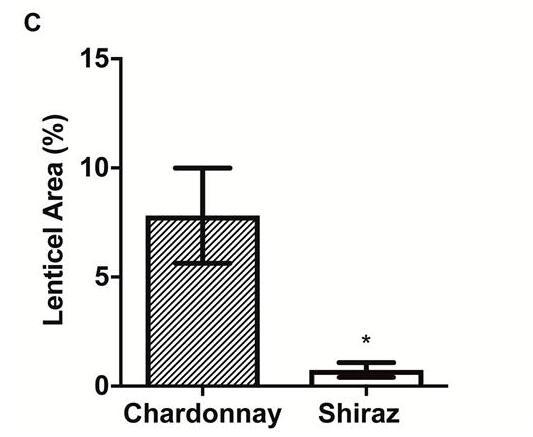
霞多丽(A)和设拉子(B)浆果花梗之间皮孔形态和相对皮孔面积的差异。(C)相对于霞多丽和设拉子浆果(室内种植,2015年)的花梗表面积,使用ImageJ估计的扁豆面积。(A)和(B)中的比例尺=1 mm。(C)中的数据是平均值±SE,n=5,*显着不同(t检验,P<0.05)。
霞多丽(A)和设拉子(B)浆果花梗之间皮孔形态和相对皮孔面积的差异。(C)相对于霞多丽和设拉子浆果(室内种植,2015年)的花梗表面积,使用ImageJ估计的扁豆面积。(A)和(B)中的比例尺=1 mm。(C)中的数据是平均值±SE,n=5,*显着不同(t检验,P<0.05)。
霞多丽(A)和设拉子(B)浆果花梗之间皮孔形态和相对皮孔面积的差异。(C)相对于霞多丽和设拉子浆果(室内种植,2015年)的花梗表面积,使用ImageJ估计的扁豆面积。(A)和(B)中的比例尺=1 mm。(C)中的数据是平均值±SE,n=5,*显着不同(t检验,P<0.05)。
为了确定花梗上的皮孔是否可以作为浆果气体交换的场所,对相同批次的浆果进行呼吸测量,这些浆果有或没有用硅脂覆盖的梗以阻碍气体交换。这在20°C和40°C下进行了检查,因为对O呼吸需求2的随温度增加(Hertog等人,1998年)。图7A显示,在40°C下用硅脂覆盖浆果梗(和皮孔)可降低设拉子和霞多丽浆果在40°C下的浆果呼吸,但对20°C下的呼吸没有影响。呼吸的温度依赖性在霞多丽和西拉更详细地进行了检查,既产生相似的活化能和Q 10(补充图S1,S2在JXB在线)没有在两天每个品种采样浆果之间不同。覆盖花梗的浆果的表观呼吸减少并不是由于花梗呼吸的消除,因为40°C时的花梗呼吸速率是总浆果呼吸的一小部分(图7B)并且没有解释减少当覆盖花梗时观察到(图7A),其中花梗覆盖的设拉子和霞多丽在40°C下的呼吸减少为839.7±101.8 nmol h–1和1233.9±229.4 nmol h–1每个浆果。
图7
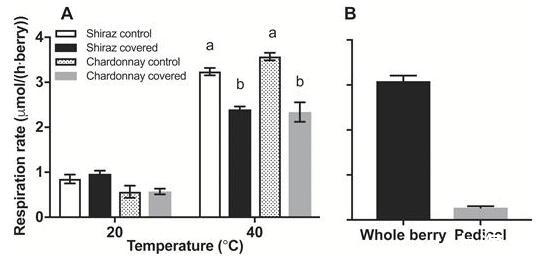
花梗在氧扩散中作为温度的函数的作用。(A)霞多丽(86 DAA)和设拉子(77 DAA)浆果(每个浆果)在20°C和40°C下的呼吸,并附有花梗(2016-2017季节)。硅脂覆盖花梗上的皮孔(覆盖浆果)。在20°C下,两个品种的对照和花梗覆盖的浆果之间的表观浆果呼吸没有显着差异。不同的小写字母表示每个品种在40°C处理之间的显着差异(双向方差分析,P<0.0001)。Shiraz和Chardonnay在40°C时每个浆果的呼吸作用分别降低了839.7±101.8 nmol h-1和1377.3±161.3 nmol h-1(降低了26%和39%)。(B)整个浆果的呼吸速率,包括附着的花梗和霞多丽在40°C下的分离花梗的呼吸。花梗占整个浆果呼吸率的9%。数据是平均值±SE,n=3。
花梗在氧扩散中作为温度的函数的作用。(A)霞多丽(86 DAA)和设拉子(77 DAA)浆果(每个浆果)在20°C和40°C下的呼吸作用,并附有花梗(2016-2017季节)。硅脂覆盖花梗上的皮孔(覆盖浆果)。在20°C下,两个品种的对照和花梗覆盖的浆果之间的表观浆果呼吸没有显着差异。不同的小写字母表示每个品种在40°C处理之间的显着差异(双向方差分析,P<0.0001)。Shiraz和Chardonnay降低了839.7±101.8 nmol h–1和1377.3±161.3 nmol h–1在40°C下的呼吸作用中,每个浆果的呼吸作用分别(降低了26%和39%)。(B)整个浆果的呼吸速率,包括附着的花梗和霞多丽在40°C下的分离花梗的呼吸。花梗占整个浆果呼吸率的9%。数据是平均值±SE,n=3。
花梗在氧扩散中作为温度的函数的作用。(A)霞多丽(86 DAA)和设拉子(77 DAA)浆果(每个浆果)在20°C和40°C下的呼吸,并附有花梗(2016-2017季节)。硅脂覆盖花梗上的皮孔(覆盖浆果)。在20°C下,两个品种的对照和花梗覆盖的浆果之间的表观浆果呼吸没有显着差异。不同的小写字母表示每个品种在40°C处理之间的显着差异(双向方差分析,P<0.0001)。Shiraz和Chardonnay在40°C时每个浆果的呼吸作用分别降低了839.7±101.8 nmol h-1和1377.3±161.3 nmol h-1(降低了26%和39%)。(B)整个浆果的呼吸速率,包括附着的花梗和霞多丽在40°C下的分离花梗的呼吸。花梗占整个浆果呼吸率的9%。数据是平均值±SE,n=3。
[O快速减少2当N时,在距离花梗约2毫米和靠近红宝石无核浆果的中心轴处观察到]的2流在花梗上被激活(图8)。
图8
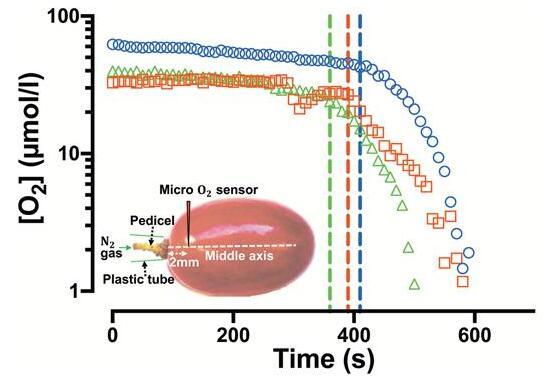
花梗在气体扩散到Ruby Seedless葡萄中的作用(2016-2017季节为132 DAA)。三个单独浆果的[O2]作为时间的函数,传感器插入大约Ruby Seedless的中心轴,距花梗约2毫米。虚线表示在花梗上开始外部N2气体输送。不同的符号表示不同的浆果。插图:在测量[O2]的同时在浆果花梗上施加N2气体的实验装置。
花梗在气体扩散到Ruby Seedless葡萄中的作用(2016-2017季节为132 DAA)。[O 2三个单独浆果的]作为时间的函数,传感器插入大约距离花梗约2 mm的Ruby Seedless的中心轴。虚线表示开始外部N 2在花梗上气体输送。不同的符号表示不同的浆果。插图:施加N实验装置2在测量[O同时在浆果花梗上气体的2]的。
花梗在气体扩散到Ruby Seedless葡萄中的作用(2016-2017季节为132 DAA)。三个单独浆果的[O2]作为时间的函数,传感器插入大约Ruby Seedless的中心轴,距花梗约2毫米。虚线表示在花梗上开始外部N2气体输送。不同的符号表示不同的浆果。插图:在测量[O2]的同时在浆果花梗上施加N2气体的实验装置。
随后使用生长箱培养的霞多丽葡萄藤进行了一项实验,以测试覆盖附着在葡萄藤上的浆果的花梗皮孔是否会影响内部[O 2]分布。用硅脂覆盖浆果梗三天后[O减少,2,中央血管区域的]并保持在0µmol l附近–1在随后的15天中(图9A)。对于对照浆果,,[O的最大值2在所有天的测量中]在中心轴处很明显。在这个实验过程中,TSS的浓度随着时间的推移而增加,并且对于皮孔覆盖的浆果来说更高(图9B)。糖/浆果不受覆盖皮孔的影响(图9C)。在覆盖花梗皮孔后第12天和第20天测量浆果的乙醇浓度。与对照浆果相比,这些浆果显示出更高的乙醇含量(图9D),这与缺氧浆果内更多的发酵一致。通过在覆盖皮孔10天后限制氧扩散,CD显着增加(图9E),这也从跨浆果的横断面检查中明显看出(图9F)。
图9
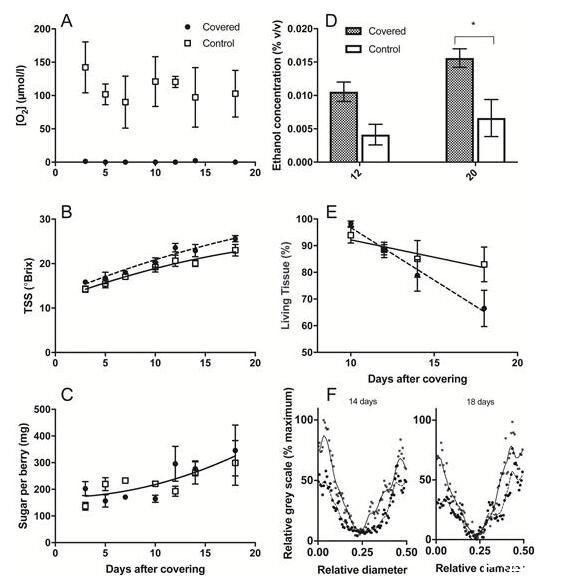
在成熟过程中用硅脂覆盖浆果花梗对完整霞多丽簇的影响(2017年种植室,空心方块=对照,实心圆圈=覆盖)。(A)[O2]在浆果的近似中心轴上作为覆盖花梗后时间的函数。双向方差分析显示覆盖花梗减少了[O2](P<0.0001)。(B)覆盖花梗后浆果的总可溶性固体(TSS)浓度随时间的变化。与对照浆果相比,花梗覆盖的浆果在实验过程中显示出显着更高的TSS(双向方差分析P=0.003;拟合为二阶多项式,实线=对照,虚线=覆盖)。(C)作为覆盖花梗后时间的函数的每个浆果的糖分。糖/浆果处理之间没有发现显着差异(组合拟合是二阶多项式,实线)。(D)12天和20天后浆果的乙醇浓度,有(填充)和没有(开放)硅脂覆盖花梗。双向ANOVA(Tukey多重比较检验)在覆盖后20 d显示出显着差异(P=0.036)。(E)作为时间函数的活组织百分比。覆盖浆果的拟合线(虚线)的斜率不为零(P=0.008),并且不同于未覆盖浆果的拟合线(实线)的斜率(P=0.006)。(F)赤道半径上的荧光信号(FDA染色,相对于最大值,高值=较高的活组织)在覆盖后14天和18天针对浆果直径的变化进行标准化。每个都显示了局部加权散点图平滑拟合(LOWESS)。覆盖(虚线)与对照(实线)在两个时间点都显着不同(双向方差分析,P<0.001)。数据是平均值±SE,n=3,除了(F)未显示SE。
在成熟过程中用硅脂覆盖浆果花梗对完整霞多丽簇的影响(2017年种植室,空心方块=对照,实心圆圈=覆盖)。(A)[O 2]在浆果的近似中心轴上作为覆盖花梗后时间的函数。双向方差分析显示覆盖花梗减少[O 2](P<0.0001)。(B)覆盖花梗后浆果的总可溶性固体(TSS)浓度随时间的变化。与对照浆果相比,花梗覆盖的浆果在实验过程中显示出显着更高的TSS(双向方差分析P=0.003;拟合为二阶多项式,实线=对照,虚线=覆盖)。(C)作为覆盖花梗后时间的函数的每个浆果的糖分。糖/浆果处理之间没有发现显着差异(组合拟合是二阶多项式,实线)。(D)12天和20天后浆果的乙醇浓度,有(填充)和没有(开放)硅脂覆盖花梗。双向方差分析(Tukey多重比较检验)在覆盖后20 d显示出显着差异(P=0.036)。(E)作为时间函数的活组织百分比。覆盖浆果的拟合线(虚线)非零(P的斜率=0.008)并且不同于未覆盖浆果的拟合线(实线)的斜率(P=0.006)。(F)赤道半径上的荧光信号(FDA染色,相对于最大值,高值=较高的活组织)在覆盖后14天和18天针对浆果直径的变化进行标准化。每个都显示了局部加权散点图平滑拟合(LOWESS)。覆盖(虚线)与对照(实线)在两个时间点都显着不同(双向方差分析,P<0.001)。数据是平均值±SE,n=3,除了(F)未显示SE。
在成熟过程中用硅脂覆盖浆果花梗对完整霞多丽簇的影响(2017年种植室,空心方块=对照,实心圆圈=覆盖)。(A)[O2]在浆果的近似中心轴上作为覆盖花梗后时间的函数。双向方差分析显示覆盖花梗减少了[O2](P<0.0001)。(B)覆盖花梗后浆果的总可溶性固体(TSS)浓度随时间的变化。与对照浆果相比,花梗覆盖的浆果在实验过程中显示出显着更高的TSS(双向方差分析P=0.003;拟合为二阶多项式,实线=对照,虚线=覆盖)。(C)作为覆盖花梗后时间的函数的每个浆果的糖分。糖/浆果处理之间没有发现显着差异(组合拟合是二阶多项式,实线)。(D)12天和20天后浆果的乙醇浓度,有(填充)和没有(开放)硅脂覆盖花梗。双向ANOVA(Tukey多重比较检验)在覆盖后20 d显示出显着差异(P=0.036)。(E)作为时间函数的活组织百分比。覆盖浆果的拟合线(虚线)的斜率不为零(P=0.008),并且不同于未覆盖浆果的拟合线(实线)的斜率(P=0.006)。(F)赤道半径上的荧光信号(FDA染色,相对于最大值,高值=较高的活组织)在覆盖后14天和18天针对浆果直径的变化进行标准化。每个都显示了局部加权散点图平滑拟合(LOWESS)。覆盖(虚线)与对照(实线)在两个时间点都显着不同(双向方差分析,P<0.001)。数据是平均值±SE,n=3,除了(F)未显示SE。
显微CT显示的葡萄浆果内的空气空间
使用微CT,霞多丽浆果在成熟过程中的两个时间点的内部气隙,其中浆果内气隙的总体积大于500个体素(1.5×10–3 mm 3),如图所示10。对于转色后(98 DAA,显色性突出了浆果内的空气空间图10A)和收获后(154 DAA,,图10B)浆果。空气空间与转色后浆果的花梗相连,但在收获后浆果中不明显。很明显,室内有更大的空气空间。浆果近端区域和种子种脐之间的孔隙率、孔隙和通道在两天采样的浆果之间没有差异(补充图S3)。
图10
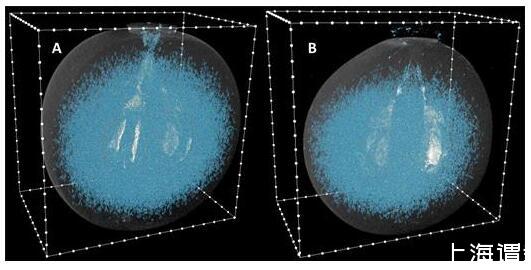
X射线显微CT确定的霞多丽浆果中的空气空间。(A)在98 DAA(19.3°Brix)和(B)在154 DAA(24.5°Brix)在2015-2016季节。图像已被处理以指示浆果轮廓。最小体素截止值为500。框轮廓上的白点间隔1毫米。
X射线显微CT确定的霞多丽浆果中的空气空间。(A)在98 DAA(19.3°Brix)和(B)在154 DAA(24.5°Brix)在2015-2016季节。图像已被处理以指示浆果轮廓。最小体素截止值为500。框轮廓上的白点间隔1毫米。
 相关新闻
相关新闻