热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
三磷酸腺苷(ATP)作为机体最直接的能量来源,参与细胞代谢和各种生化反应,在维持大脑功能过程中扮演重要角色。在正常生理状态下,脑内ATP的浓度受到严格的调节,而当ATP浓度偏离平衡时则会引发阿尔兹海默病、帕金森病等多种脑疾病。因此,发展脑内ATP的活体原位检测方法对于研究相关的生理和病理过程具有重要意义。基于微电极的电化学活体分析法在脑科学研究中已做出了重要贡献。
在本文中,我们将UCNPs与四甲基罗丹明(TAMRA)标记的ATP适配体(cATP),组成荧光共振能量转移(FRET)体系,以碲化镉量子点(CdTe QDs)作为光电活性材料,共同修饰于微电极表面,构建可近红外激发的ATP光电化学微传感器。该PEC微传感器已成功应用于药物诱导的炎症小鼠模型中脑内ATP的活体原位检测。
FRET调控光电流信号的可行性
将光电材料和UCNPs组成的荧光探针依次修饰到微电极上,并测试了不同修饰电极的光电流响应。由于CdTe QDs-MWCNTs在980 nm波长处的吸收很弱,因此在980 nm的近红外光的激发下,只有CdTe QDs-MWCNTs修饰微电极表现出微小的光电流信号(图1曲线a)。当CdTe QDs-MWCNTs和UCNPs共同修饰到微电极表面后,UCNPs/CdTe QDs-MWCNTs/微电极在含有200μmol/L AA的aCSF中表现出最强的光电流信号,为315.2 nA(图1曲线b),说明UCNPs的发光能够有效激发CdTe QDs并产生光电流信号。修饰cDNA后,cDNA/UCNPs/CdTe QDs-MWCNTs/微电极的光电流略微减小,为285.3 nA(图1曲线c),表明cDNA在电极表面的成功修饰。将TAMRA-cATP修饰到UCNPs后,由于TAMRA对UCNPs发光的猝灭作用,TAMRA-cATP/cDNA/UCNPs/CdTe QDs-MWCNTs/微电极的光电流显著降低,为91.3 nA(图1曲线d)。TAMRA-cATP/cDNA/UCNPs/CdTe QDs-MWCNTs/微电极与ATP(80 nmol/L)反应后,光电流明显增强,为185.5 nA(图1曲线e)。以上实验结果表明,ATP与适配体之间的特异性结合能够引起光电流信号的改变。
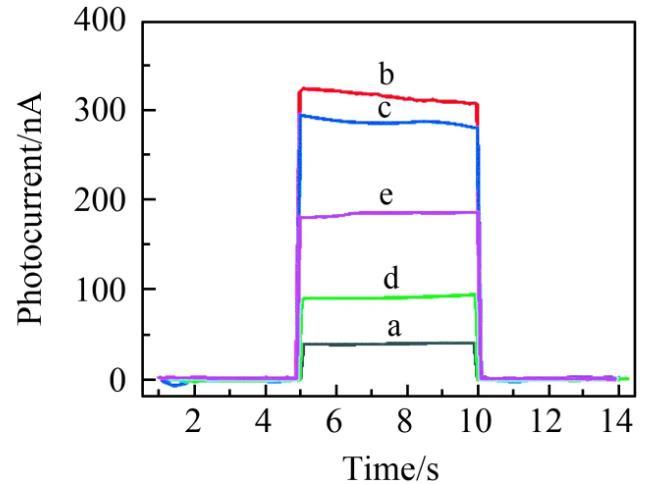
图1不同修饰电极的光电流大小:(a)CdTe QDs-MWCNTs/微电极;(b)UCNPs/CdTe QDs-MWCNTs/微电极;(c)cDNA/UCNPs/CdTe QDs-MWCNTs/微电极;(d)TAMRA-cATP/cDNA/UCNPs/CdTe QDs-MWCNTs/微电极;(e)TAMRA-cATP/cDNA/UCNPs/CdTe QDs-MWCNTs/微电极与ATP反应后
传感器对ATP的响应研究
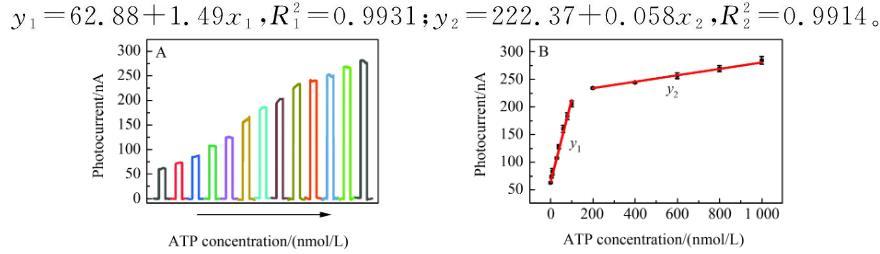
图2(A)微传感器与不同标准浓度ATP反应后的光电流响应;(B)光电流大小与ATP浓度之间的线性关系
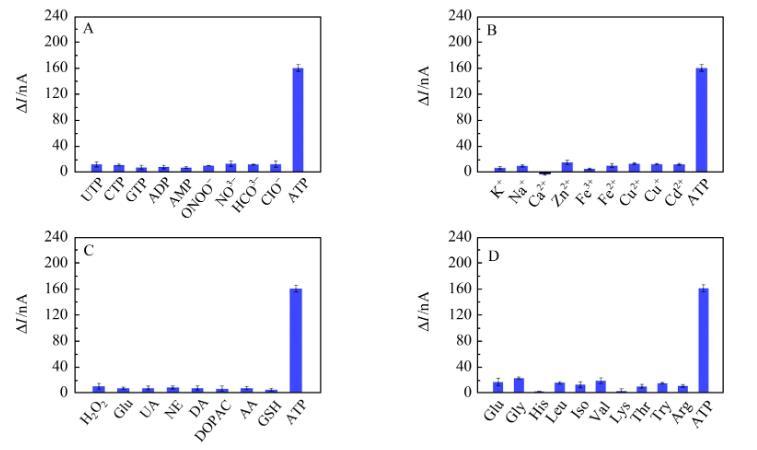
传感器的选择性研究
由于活体环境复杂,传感器的选择性对活体分析十分重要。因此,我们考察了活体生物环境中共存的一些结构类似物、阴阳离子和氨基酸等物质对微传感器的影响。如图3所示,共存物质对微传感器的光电流信号基本没有影响或者影响较小,当加入ATP时,光电流显著增加,说明该微传感器对ATP具有很高的特异性。
 相关新闻
相关新闻