热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
材料与方法
小鼠、试剂和细胞系
C57BL/6雌性小鼠,6-8周龄,饲养温度为25-29℃,湿度为50-76%,光/暗周期为12/12。所有涉及动物的实验均经中国四川西南医科大学机构动物护理和治疗委员会审查批准。所有动物实验均按照美国国立卫生研究院《实验动物的护理和使用指南》。
实验中使用的LLC细胞系在PPMI-1640细胞培养基中保存。将约1×106个LLC细胞加入0.1毫升磷酸盐缓冲液(PBS)中,皮下注射到C57BL/6小鼠的右后腿近端。
人重组内皮抑素Endostatin(rh-ES)储存于4℃。然后将Endostar溶解在0.2毫升的0.9%生理盐水(NS)中,以10毫克/千克/天的剂量对每只动物进行腹腔注射(IP)。
吉西他滨根据之前的研究,将吉西他滨溶解在0.2毫升0.9%NS中,以每只动物30毫克/千克的剂量进行腹腔注射。
治疗组
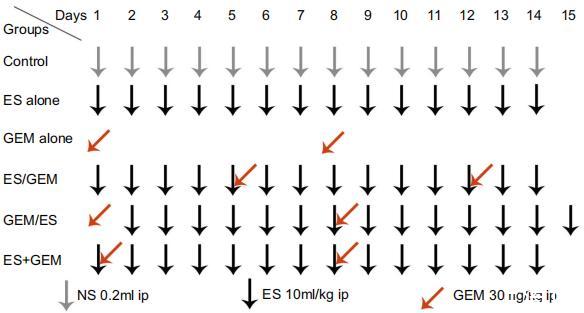
图1、治疗方案。
LLC接种10天后,将肿瘤小鼠随机分为对照组、单用Endostar(ES)组、单用吉西他滨(GEM)组、先用Endostar组(ES/GEM)、先用吉西他滨组(GEM/ES)、Endostar和吉西他滨同时使用组(ES+GEM)(n=12,每组)[图1]。简言之,i)对照组(阴性对照)不作任何处理;ii)单用ES(10毫克/千克/天,14天);iii)单用GEM(30毫克/千克/天,第1天和第8天给药);iv)ES/GEM(Endostar在第1-14天给药,吉西他滨在第5天和第12天给药);v)GEM/ES(第2-15天服用Endostar,第1天和第8天服用吉西他滨);vi)ES+GEM(第1-14天服用Endostar,第1天和第8天服用吉西他滨)。每两天用卡尺测量一次肿瘤体积,肿瘤体积按以下公式计算:V=½ab2(其中V为肿瘤体积,a为主轴长度,b为次轴长度)。治疗结束后,小鼠被处死。
流式细胞仪分析
解剖肿瘤组织并将其制成单细胞悬液。单细胞悬浮液在70%的冷乙醇中固定12-24小时。然后,以1,000r/min的转速离心1分钟,沉淀悬浮液。细胞在PBS(pH7.4)中冲洗2-3分钟,然后以2,000r/min的转速离心3-4分钟。然后用碘化丙啶(PI)染色,进行细胞周期分析。
免疫组织化学
用10%的中性甲醛固定肿瘤组织,用石蜡包埋并切成3μm的切片。然后,用苏木精和伊红(H&E)染料对切片进行染色。随后,用特异性抗体处理切片进行分析。简而言之,切片用兔抗鼠血管内皮生长因子或α-平滑肌肌动蛋白(α-SMA)一抗染色,然后用辣根过氧化物酶(HRP)结合的山羊抗鼠二抗孵育。然后用二氨基联苯胺(DAB)孵育切片并用苏木精反染。
VEGF表达分析的计算方法如下:从每组6个肿瘤的切片中随机选取5个区域。在400倍放大镜下,将VEGF阳性细胞数除以细胞总数×100%。细胞质呈中度或浓棕色染色为阳性,细胞质未染色或呈浅棕色染色为阴性。
α-SMA表达分析的计算方法如下:从每组6个肿瘤的切片中随机抽取5个区域。按照之前的描述,在200倍放大镜下计算每平方毫米肿瘤样本中α-SMA阳性图谱的数量。
氧微电极
肿瘤组织中的氧分压(PO2)由氧微电极(UnisenseA/S)测定。所有操作均按照制造商的说明进行。简而言之,在对微电极进行极化和校准后,将麻醉动物置于俯卧位。然后将微电极垂直插入肿瘤组织。计算肿瘤组织1/2、1/4、1/8和1/16短直径处的PO2。然后使用数据采集软件SenseTrace Pro(UnisenseA/S)记录获得的数据。为了观察缺氧的变化,在第5、10和15天测量了每组5只动物的PO2。
显微18F-FDG PET/CT成像
采用Inveon micro PET/CT动物扫描仪测量各组小鼠的早期肿瘤反应。治疗结束后,每组3只小鼠禁食6-8小时,然后用1%戊巴比妥(5毫克/千克,IP)麻醉,静脉注射2-脱氧-2-[氟-18]氟-D-葡萄糖(18F-FDG)100-200微居里(μCi)。注射18F-FDG30分钟后,将小鼠固定在扫描架上,以进行微正电子发射计算机断层扫描(PET/CT)成像。选择肿瘤外观最大的图像平面进行数据分析。手动绘制包含整个肿瘤的不规则感兴趣区(ROI)。根据ROI,通过计算标准摄取值,在衰减校正后的横轴断层切片中确定肿瘤的示踪剂摄取值。从选定的ROI获取最大标准化摄取值(SUVmax)。