热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
本文自制钴酸锂粉末微电极,运用电化学手段研究氧化亚铁硫杆菌氧化钴酸锂的电化学行为,以便对反应控制步骤及时做出有效的强化措施,为强化钴和锂浸出率提供理论基础。
自制钴酸锂粉末微电极
工作电极的制作:剪取1根长4 cm直径为50μm左右的铂丝和1根长10 cm直径为1 mm左右的铜丝,用直径为50μm左右的铜丝将他们的两端缠绕联接在一起,使铂丝的露出长度约1.5 cm,将之放于一管壁较厚口径较小的玻璃管中,置于酒精喷灯下高温灼烧,待加热到玻璃管熔点时,用老虎钳对玻璃管进行反复加压,使铂丝紧密封焊于玻璃管端口中,另一端用环氧树脂进行固定。
用水相砂纸、3#和6#金相砂纸依次对电极进行打磨,使铂丝露出玻璃端口表面,并用粉末粒径为0.03μm的氧化铝对其表面进行抛光。然后分别用自来水冲洗,二次蒸馏水、丙酮超声清洗。将该微电极在微沸的王水中腐蚀铂微盘电极端面。腐蚀过程中用显微镜观察电极,控制腐蚀深度约为20~50μm。将腐蚀好的电极依次用蒸馏水、丙酮及二次蒸馏水进行超声清洗,待干燥后,再将钴酸锂粉末在玻璃板上经过充分研磨后严实地填人到电极顶端的微孔中,即得到钴酸锂粉末微电极(见图1)。
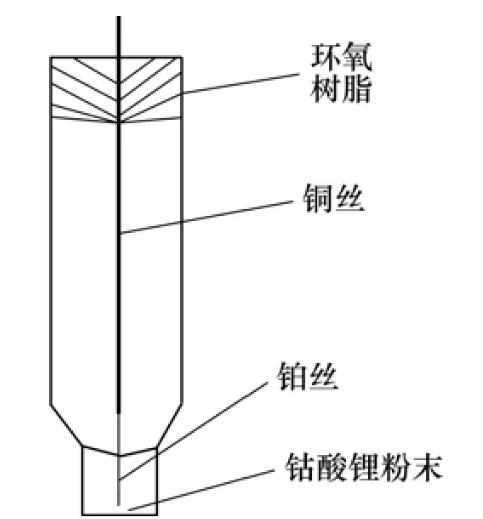
图1钴酸锂粉末微电极
电化学行为研究
钴酸锂在9K培养基中的点腐蚀电位
钴酸锂粉末微电极无菌条件下的开路电位明显大于有菌,无菌条件下的开路电位在0.34 V左右,而有菌0.32 V左右。无菌条件下开路电压较高,说明有菌条件下钴酸锂开始氧化腐蚀的电位更低,使得钴酸锂更容易被氧化腐蚀,所以细菌促进钴酸锂的氧化腐蚀。
钴酸锂浸出的氧化还原过程
无菌钴酸锂电极重复循环伏安
钴酸锂粉末微电极无菌条件下的重复循环伏安扫描结果(pH为2,扫描速度Rs=50 mV/s,T=298 K)。在初始阳极方向第1次扫描时,电流在0.581 V后随着电位的增加而明显增加,在1.172 V出现阳极峰,峰电流为6.004μA,峰电流越大,说明通过粉末微电极的电流越大,极化反应速度较快;阳极氧化后第2次阴极循环时,相同电位区能看见较大的电流峰,此峰电流比初始阳极扫描产生的峰电流强,且随扫描次数增加略增强,表明阳极氧化对阴极还原峰的形成具有重要作用,第2次循环氧化反应程度加强,氧化速率加快。
氧化峰A的反应峰比较宽,可能对应着几个反应,分别为:
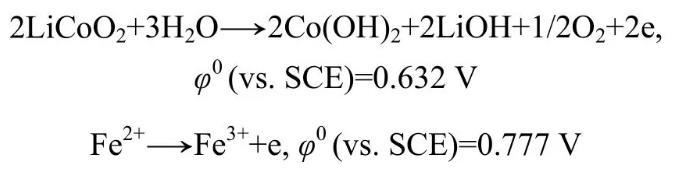
由实验结果可知:钴酸锂阳极氧化主要是发生钴酸锂水解释放氧气,重复循环扫描时,阳极峰A电位发生移动,说明不是直接的阳极氧化反应电流峰,而是几个反应的叠加。
电极负方向往回扫描时,出现了2个紧挨着的明显的还原峰,还原峰C很宽,对应着一系列的还原反应,其中可能发生的反应为:
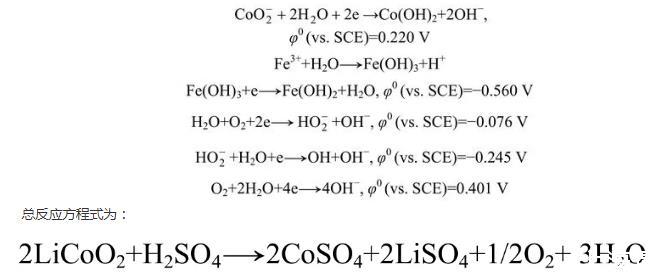
有菌钴酸锂电极重复循环伏安
钴酸锂电极在有细菌浸出条件下的循环伏安曲线。第1次阳极方向扫描时,有菌和无菌条件下都在0.581 V开始电流随着电位的增加而明显增加,在1.172 V左右出现阳极峰A,但峰电流为8.554μA,明显大于无菌条件下的峰电流,说明细菌存在时明显加速了亚铁离子的氧化以及钴酸锂的溶解。并且第二次扫描时,在1.134 V电位处峰电流为9.781μA,此峰电流比第一次扫描产生的峰电流强,且随扫描次数增加略增强,表明阳极氧化对阴极还原峰的形成具有重要作用。
有菌和无菌的区别在于亚铁离子在细菌作用下能更快速的氧化成铁离子:
钴酸锂粉末微电极在温度25℃、扫描速度10 mV/s条件下的线性扫描曲线。起始电位在平衡电位附近,当电位向正方向扫描时,电极得电子的还原反应速度将不断增大,电流也不断增大,反应物消耗的量也不断增大,随着电化学反应速率的不断增大,电极表面附近的反应物浓度不断下降,这时反应物由溶液内部向电极表面扩散量的不断增加。当扫描到达0.420 V左右,电流随电位的升高而增大,钴酸锂氧化溶解速度加快,有菌条件下对应着的反应电流明显大于无菌条件下的反应电流。钴酸锂在有菌和无菌酸性体系中的点蚀电位φcorr相同,即φcorr,1=φcorr,2=0.420 V,对应着反应电流I2>I1。在有菌条件下,由氧化曲线2可见:当电极正向扫描到0.776 V时,电流迅速减小,形成了一层钝化膜,当电位达到了钝化电位0.802 V以后,电流随扫描电位增加而增加,钝化膜被击穿。所以,由结果可知:在25℃、扫描速度10 mV/s条件下,钴酸锂在溶液中的腐蚀电位为0.420 V,致钝电位为0.776 V,钝化电位为0.802 V。在无菌条件下,由于氧化电流小,不产生钝化膜。
 相关新闻
相关新闻