热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
数据分析
GRAPHPAD PRISM 5.0(GRAPHPAD Software Inc.,圣地亚哥,加利福尼亚州,美国)用于单因素或双因素方差分析(Tukey或Bonferoni事后检验)和学生t检验,以比较均值。在水下净光合作用与外部CO2或O2浓度的实验中,也使用GRAPHPAD PRISM将数据集拟合到预测模型(高斯和Michaelis-Menten)。
黎明和黄昏时叶片有机酸和可滴定组织酸度
黎明和黄昏苹果酸或可滴定组织酸度的比较是CAM活性的诊断测试(Lu–ttge,2004),因此,我们在澳大利亚鸢尾的叶绿叶部分(即绿色叶尖)测量了这些参数。与黄昏相比,黎明时苹果酸浓度高9.7倍,表明CAM活性(图2)。柠檬酸盐浓度在黎明时也较高,尽管昼夜振幅低得多(1.9倍),黎明时的绝对浓度仅为苹果酸的24%(图2)。叶匀浆的可滴定酸度从黎明时的250变化到黄昏时的4 lmol H+当量g)1 FW(图3),支持了存在大量CAM活性的结论。此外,当滴定开始于或低于苹果酸的第一个pKa时,D苹果酸与D酸度的比率为0.46,接近预期值0.50。因此,苹果酸是用于储存夜间固定二氧化碳的主要有机酸(图2)。
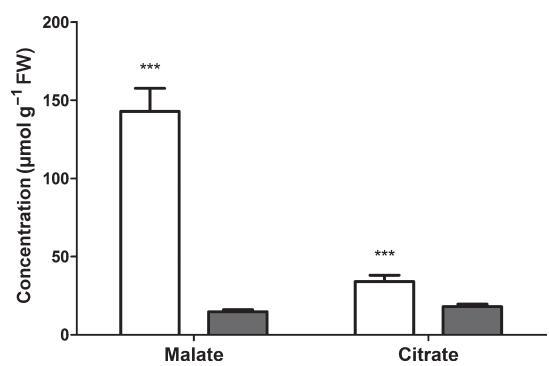
图2沉水水韭叶片中的有机酸(苹果酸和柠檬酸)。在黑暗前16小时后的黎明(开放柱)或在光线下8小时后的黄昏(封闭柱)对组织进行采样。条形代表平均值±SE(n=4)***苹果酸和柠檬酸的黎明和黄昏值显着不同(P<0.001;Student t检验)。
不同苹果酸状态叶片水下净光合作用对溶解CO2的响应
已假设CAM的存在可以在沉水植物中外部CO2较低时维持净光合作用(Madsen,1987)。我们通过比较苹果酸高(黎明)或低(黄昏)叶片的CO2响应曲线来测试CAM活性的潜在益处。水下净光合作用的CO2饱和速率在高苹果酸和低苹果酸叶片之间没有差异,在这两种情况下均为2.3 lmol O2 m)2 s)1(图4)。高苹果酸和低苹果酸叶片的响应曲线在300 mmol CO2 m)3及以下显着偏离,低苹果酸叶片的水下净光合作用较低。苹果酸含量高的叶片水下净光合速率高,这可能与苹果酸脱羧更多导致的CO2更高可用性有关。
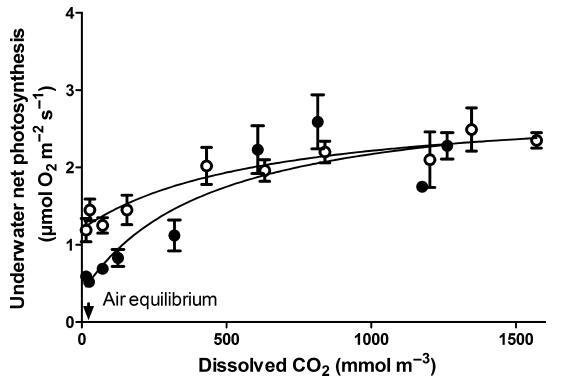
图4水下净光合作用与20℃下140 mmol O2 m)3培养的浸没水韭叶片中外部CO2浓度的关系。在黑暗前16小时的黎明(高苹果酸,开放圆圈)或在光线下8小时后的黄昏(低苹果酸,封闭圆圈)对组织进行采样。每个数据点代表平均值±SE(n=5)。数据拟合到具有y轴常数的Michaelis-Menten模型。
表观光呼吸的评估;对比苹果酸状态下叶片水下净光合对O2的响应
沉水植物的光呼吸可能很高,尤其是当CO2耗尽且O2增加远高于空气平衡时,因此Rubisco的CO2:O2比率较低。由于CAM可以抑制陆生植物的光呼吸(Lu–ttge,2002),我们评估了苹果酸含量高或低的南花蓟马叶片的光呼吸是否不同。通过研究增加O2对水下净光合作用速率的影响来评估表观光呼吸(图5)。
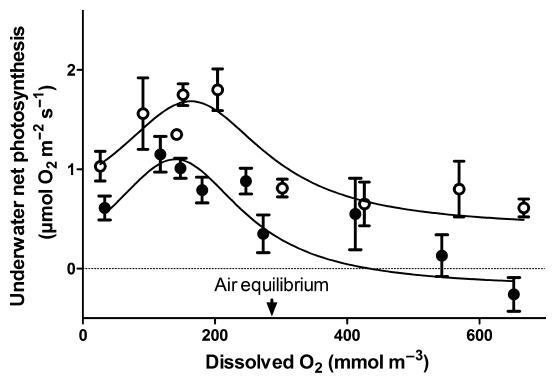
图5.水下净光合作用与水下水韭叶片中外部O2浓度(孵化期间的平均值)的关系,该叶片取自水下水韭,并在20℃下用30 mmol CO2 m)3孵化。在前一个黑暗16小时后的黎明(高苹果酸,开放圆圈)或在光照8小时后的黄昏(低苹果酸,封闭圆圈)对组织进行采样。每个数据点代表平均值±SE(n=5),数据拟合到高斯模型。20℃时,O2在水中的空气平衡为284 mmol m)3。
苹果酸含量低的叶片的表观光呼吸显着高于苹果酸含量高的叶片;当溶解氧浓度为空气平衡浓度的2.2倍(即625 mmol m)3时,低苹果酸组织的净光合作用为负值,而高苹果酸组织的净光合作用虽然降低,但仍为正值(图5)。当溶解的O2处于空气平衡时,低苹果酸叶片的光呼吸甚至显着;空气平衡时的净光合作用仅为这些叶片最大速率的31%——净光合作用速率在140 mmol O2 m)3时最高,约为空气平衡时溶解O2浓度的一半。在高苹果酸叶片中,虽然净光合作用在溶解氧浓度为160 mmol m)3时最大,但当O2处于空气平衡时,净光合作用仅降低到最大速率的67%。此外,在这种含30 mmol CO2(m)3的溶液中,高苹果酸叶片的最大水下净光合作用是低苹果酸叶片的1.5倍。在284 mmol O2 m)3下,净O2产生量(即表观光呼吸)的减少超过Rd(Rd=0.14±0.02 lmol O2 m)2 s)1的5.7倍;n=4),因此推断的光呼吸明显超过Rd。除了在高O2下净光合作用下降外,在最低测试O2浓度(25 mmol m)3下也下降,可能是由于组织缺氧。总之,随着CO2:O2的减少,具有高CAM的叶片(即高苹果酸叶片)表现出较低的表观光呼吸,因此CAM脱羧作用较低。
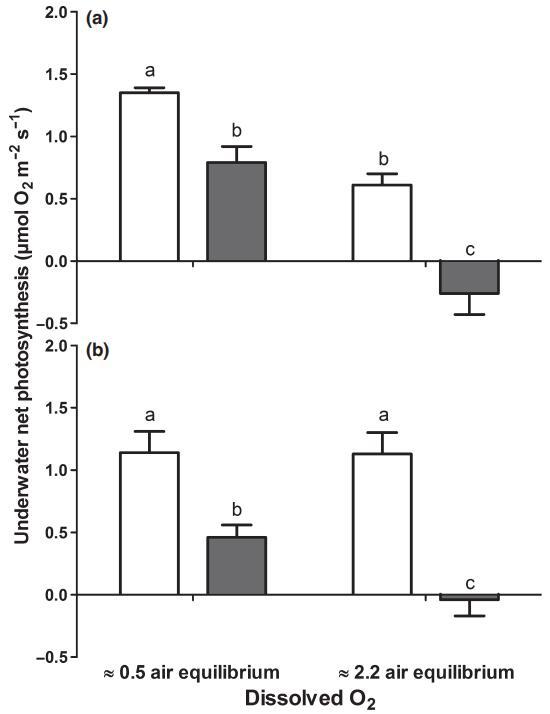
图6在低(c.0.5空气平衡;140 mmol m)3)或高(2.2倍空气平衡;625 mmol m)3)外部O2浓度下测得的从水韭(a)或在空气中形成的叶子(b)中采集的叶子的水下净光合作用。在20°C下对黎明时采集的叶片(高苹果酸,开放条)在黑暗中16小时后进行测量,或在黄昏时采集的叶片(低苹果酸,封闭条)在光线下8小时后进行测量。条形代表平均值±SE(n=4),字母表示组织类型和治疗之间的显着差异(P<0.05)。
空气中形成的叶片的水下净光合作用
当几种水韭物种出现在水面上时,在空气中形成的叶子会形成气孔,它们在C3光合作用中直接利用大气中的CO2,而CAM活性则会丧失,这可以通过低D酸度来证明(Keeley等人,1983a,b)。南方水韭也能够与暴露在空气中的枝条一起生长,但在空气中形成的叶片仍然缺乏气孔,尽管叶片周转量约为1叶wk)1(Keeley,1983b)。我们评估了在空气中形成的叶片的气孔、钙调素活性和水下净光合作用的存在情况(植物脱浸水6周),并与在水下形成的叶片(持续浸水)进行了比较。在浸水基质中,叶片在空气中放置6周的植物,没有气孔。空气中形成的叶片中苹果酸浓度在黎明时也保持较高(103±21 lmol g)1 FW;平均值±SE,n=3;参143±15 lmol g)1 FW在沉水植物叶片中;图2)。当测试在空气中形成的叶片对水下净光合作用的影响时(图6),发现黎明时采集的样本(苹果酸含量高)比黄昏时采集的样本(苹果酸含量低)受影响较小,这进一步证明了在空气中形成的叶片中存在大量CAM活性。与水下叶片观察到的模式类似,在外部O2升高的情况下,低苹果酸叶片(黄昏)的水下净光合作用受到强烈限制;这些苹果酸含量低的叶片表现出O2的净消耗(高表观光呼吸;图6)。总之,在空气中形成的叶子维持CAM活性。
讨论
本研究评估了CAM对受到低CO2和高O2浓度挑战的植物水下净光合作用的影响,这些条件通常存在于湿地和岩石池中,可能导致高光呼吸。比较了高苹果酸浓度和低苹果酸浓度(即预期分别具有高脱羧率和低脱羧率)的水生物种即australis的叶子。CAM活性高的叶片保持较高的水下净光合作用,尤其是在较低的外部CO2浓度下,并且具有较低的表观光呼吸,尤其是当O2浓度增加时。这些发现证明了CAM光合作用对沉水植物的潜在益处,因为水下CO2和O2浓度的波动可能很大(Van等人,1976年)。例如,日出后,水中的CO2浓度通常会随着时间的推移而降低,O2浓度会随着时间的推移而增加,日落后,情况会相反(Keeley&Rundel,2003)。
CAM导致的光呼吸减少可能与生长在动态CO2和O2浓度栖息地中的I.australis和其他水生物种有关。浅季节性游泳池的溶解氧昼夜变化剧烈,下午浓度高(西澳大利亚临时花岗岩岩游泳池为35 kPa(数据未显示),加利福尼亚春季游泳池为30 kPa(Keeley,1983a))。水柱的这种过饱和将显着限制澳大利亚鸢尾的水下光合作用,但对苹果酸浓度高的叶片影响较小(图5和6)。然而,由于水中的O2浓度未达到空气平衡浓度的2.2倍,预计CAM活性对光呼吸的原位保护将在图5和6所示的极限范围内,当下午晚些时候O2浓度最高时,大部分苹果酸通常已经脱羧基(Keeley等人,1983a)。然而,由于即使在O2的亚大气平衡条件下,CAM也会限制光呼吸(图5),因此预计CAM在抑制光呼吸方面的有益作用仍会在当天早些时候出现。澳大利亚I.australis中的高CAM活性可能表明,澳大利亚临时花岗岩岩池是CCMs,尤其是CAM对维持高水下光合作用至关重要的环境。CCMs在岩石池中的重要性进一步得到共生物种中的光合途径的支持(克拉苏拉natans,CAM;Eleocharis,CAM和有时C4的物种;Marsilea的物种,未知但不是CAM;Keeley,1998a,b)。
长期以来,基于与缺乏CCM的水生物种相比,具有CCM的水生物种水下净光合作用的CO2补偿点较低,人们一直认为CCM会减少水生植物的光呼吸(Salvucci&Bowes,1983;Madsen,1987)。在这里,在O2浓度范围内测量可用于脱羧的苹果酸量不同的组织的水下净光合作用,可以评估表观光呼吸(图5)。光呼吸随着净O2产生率的下降而明显(光呼吸相对于光合作用增加),甚至在培养基中(因此在叶片内)高O2:CO2时O2的净消耗。与苹果酸浓度高的叶片相比,苹果酸浓度低的叶片的表观光呼吸显着更高;例如,即使在空气平衡的O2溶液中,低苹果酸叶片中的光呼吸已经相当显着(净O2生成量减少到最大值的31%)。CAM是一种非常有效的CCM;例如,苹果酸脱羧可导致沉水单花滨藜的腔隙中的CO2浓度高达30000ppm(Madsen,1987);这种CO2浓度比大气浓度高85倍,有望在Rubisco产生有利的CO2:O2比,减少光呼吸。
水韭叶片中的钙调素活性随季节和环境而显着变化。例如,与夏末相比,bolanderi水韭在春季的CAM活性要低得多(Keeley等人,1983b),与季节性池塘相比,从寡营养湖泊采样时,howellii水韭的组织酸度日变化较小(图3,Keeley等人,1983a)。将目前的结果与其他已发表的数据进行比较也表明,澳大利亚锥虫中的CAM活性可以高度可变(图3);D苹果酸的范围从c.25(Keeley,1983b)到140 lmol g)1 FW(本研究),D苹果酸的后一个值是水韭属的第二高值。然而,对于I.australis来说,D苹果酸的一些变化可以通过我们对叶子的叶绿素部分进行的组织分析来解释,而其他研究可能使用了整个叶子,包括有时占叶子很大一部分的无色素部分(Keeley等人,1984)。即便如此,只有从加利福尼亚州马瑟池采集的霍韦利氏锥虫显示出较高的D组织酸度和D苹果酸。
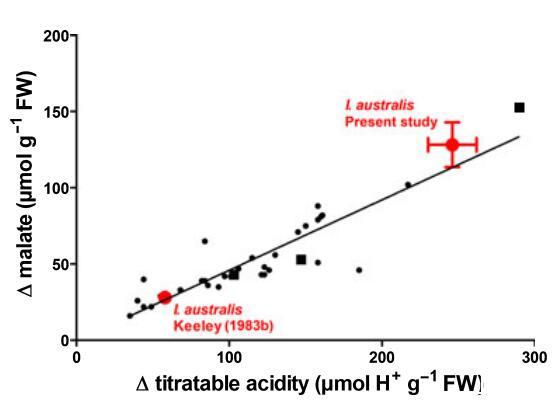
图3水韭属植物(水韭属,小圆;水韭属,大圆;水韭属,正方形)叶片中组织可滴定酸度与D苹果酸的变化(D)。D可滴定酸度和D苹果酸的计算方法为黎明(am)减去黄昏(pm)。回归线基于整个数据集,斜率为0.46。数值来自Keeley(1983b)和本研究(两个参数的平均值±SE);仅包括通过滴定至pH 6.4确定可滴定酸度的值。该图由Keeley(1998a)修改并重新绘制,添加了本研究的值,以强调物种内组织苹果酸和可滴定酸度的范围。因此,I.australis和I.howellii使用大符号突出显示。
CAM是水生植物水下光合作用的重要CCM的结论得到了植物在水下时的诱导支持,但当叶子出现在空气中时会受到抑制;例如,在水韭属物种中(Keeley等人,1983a),Littorella(Robe&Griffiths,2000),Orcuttia calafornica和Orcuttia viscida(Keeley,1998b)。在本研究中,I.australis在空气中形成的叶片中保持CAM活性(图6),这些叶片不形成气孔,这一反应类似于半边莲,半边莲在空气中也不形成气孔(Pedersen&Sand Jensen,1992)。由于在整个生长季节,临时浅层花岗岩岩池可能会以不可预测的方式干涸和重新填充,因此,I.australis的自然环境可能会选择这种更为保守的“结构性CAM策略”,当旱季开始时,在沉积物也干化和植物干燥之前,空气中有叶子的突现阶段可能持续很短(天)。这两种环境特征可能意味着,在CAM和C3之间来回切换几乎没有益处。
综上所述,利用栖息在临时花岗岩露头上的季节性水池中的一种CAM物种I.australis,本研究表明,在低外部CO2浓度下,苹果酸脱羧含量高的叶子不仅增强了水下净光合作用,而且明显的光呼吸也受到CAM的抑制。在溶解氧浓度范围内(包括低于空气平衡的值)明显抑制表观光呼吸,本研究表明,具有CAM的水生物种的光呼吸受到显着抑制。
致谢
非常感谢Dion Nichol帮助获得许可,对Allan和Craig Nichol在Mukinbudin的房产进行花岗岩岩池调查和工作。我们还感谢CLEAR、Villum Kann Rasmussen卓越中心和丹麦科学理事会的财政支持。
 相关新闻
相关新闻