热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
摘要:选择性微电极技术是一种不仅能直接测定活的生物细胞或细胞器内的离子或分子活度,而且能对活的生物相邻的位置、功能和代谢速率可能不同的特定微区细胞表面的离子或分子流(flux)分别测定的电生理方法。具有操作简便、实时、非入侵性(测定移动速率时)、灵敏度高(可达10-12molescm-2s-1)等优点。因为它是用微型化(尖端直径为0.5~53μm)的离子或分子选择性电极直接对准样品测定,不同于其它化学测定需取样品,所以能连续测定和自动监测,具有广阔的应用前景。该文阐述了选择性微电极测定原理,总结了选择性微电极技术在植物生理学研究中的应用进展,并展望了其发展前景。
植物在生长发育过程中,不断从环境中吸收水分和摄取各种矿质元素,并进行O2和CO2等气体交换。研究人员通常是以植物的器官或组织作为研究对象,来了解矿质元素、O2和CO2等在植物生命过程中的运输方式、作用机理。随着各种微电极的发展,应用微电极对单个细胞或完整植株特定微区细胞进行研究已经成为可能。

离子/分子选择性微电极是一种连接了电位计或电流计后,可以对溶液中某些特定离子/分子活度给出电位/电流指示的电极。构成微电极的材料,已从传统的玻璃发展到金属、高分子聚合物、碳丝、光纤及其它纳米材料。20世纪50年代以来,随着离子选择性微电极的出现和发展(Hinke 1959;Berman和Hebert 1974;Sykoνά等1981),离子选择性微电极也开始被用来研究植物(Bowling 1972)。80年代后,选择性微电极技术发展较快,在动物和人体上研究较多,近年来在植物上的研究报告越来越多,有测定生物体液泡(Walker等1995)和细胞质(Carden等2001)中离子的活度的微电极技术(Carden等2003);基于离子/分子选择性微电极技术发展而来的技术,即“非损伤微测技术”包括如下技术:1)自参比技术(Self-Referencing Technolog)(Kühtreiber和Jaffe 1990);2)生物体表面离子信息的微电极离子流测定(microelectrode ion flux measurement,MIFE)技术(Newman等1987;Shabala 2000;Newman 2001;Shabala等2005);3)扫描离子选择电极技术(scanning ion-selective electrode technique,SIET)(Kunkel等2001;Kunkel等2005;Vincent等2005;Xu等2006)和4);还有用于测定生物体表面分子信息的扫描极谱电极技术(scanning polarographic electrode technique,SPET)(Kunkel等2005;Xu等2006);因此微电极技术的最大特点在于,它能准确地测定单个细胞或完整植株特定微区细胞内外离子或分子的活度与流动,被用于研究植物对离子或分子吸收、释放及跨膜运输的机制。它具有操作简便、实时、灵敏度高、非损伤性等特点,而且还可以在电脑控制下连续测定与自动监测,实现了生物体内外离子或分子信息的同时进行的实时测定(Kunkel等2005;Xu等2006)。
1选择性微电极的工作原理
植物细胞内的离子或分子进出细胞时,在细胞的内外之间会形成一个跨膜的电化学势梯度(Δψm)。当离子选择微电极置于细胞或组织表面时(图1),微电极可以对溶液的离子浓度做出响应,由于细胞可以吸收或释放离子或分子,与细胞或组织表面离子或分子的浓度存在着浓度梯度,因此,会产生离子或分子的扩散性移动,传感器产生的信号经放大器的放大输出到计算机,就可以实时地检测到细胞或组织表面离子或分子流动的变化。计算离子或分子的移动速率,离子扩散是可依据Fick第一定律进行计算(Kühtreiber和Jaffe 1990;Xu等2006),也可依据能斯特(Nernst)方程(Newman 2001)计算。
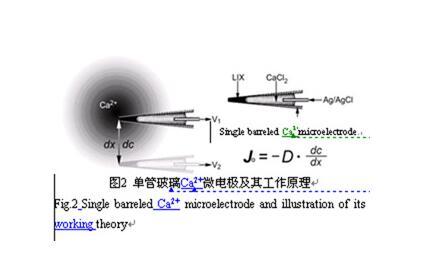
1.1依据Fick定律推导离子移动速率
离子选择性微电极在待测离子浓度梯度中对已知的两点的距离(dx)进行测定,分别获得电压V1和V2(图2)。两点间的浓度差(dc)从V1、V2及已知的该电极的电压/浓度校正曲线计算就可以获得。D是离子或分子特异的扩散系数(单位:cm-2s-1),将它们代入Fick的第一扩散定律公式:
Jo=-D·dc/dx,可获得该离子的移动速率(Jo,单位为moles·cm-2·s-1)。
1.2依据能斯特方程推导离子移动速率
在测定开始时,微电极的尖端位于被测试材料距离x的位置,在距离x处,溶液中离子的电化学势为μ(J/mol)。根据离子的自由浓度c和电势Vb,μ可以根据如下公式计算:
μ=μo+RT㏑γc+zFVb,式中μo为电化学势参考值,z为离子化合价数,γ为离子在溶液中的活动系数,F为法拉第常数(96500 C/mol),R为气体常数(8.3 J mol-1K-1),T为热力学温度(K)。当离子选择微电极的尖端缓慢移动(不搅动溶液)一段距离(dx)时,新位置处的电化学势为μ+dμ,此处的dμ为新位置处的浓度c与电势Vb的变化值,而电化学势参考值μo不变。标准电化学理论认为,根据离子浓度c(mol/m)、离子的运动速度u(m s-1mol-1newton-1)以及电化学势梯度(dμ/dx),就能计算出离子的净流量J(mol m-2s-1):
J=cu(dμ/dx)。在电极的内部,离子浓度是固定的,因此dμ就表示为内部电压(V)的变化即dV,理想状态下dμ=zFdV。V可以用静电计测定,当电极移动一段距离dx时,静电计测定值为dV。对于某一特定离子,u为已知的常数。因为LIX并不总是表现为理想的Nernst行为,实际测定的内部dV通过一个因子g(约接近1.1)降低外部的dμ。因为这个原因,需要把外部dμ与内部测定的dV联系起来,公式应为dμ=zFgdV。因此离子的净流量J就可由如下公式计算:
J=cu zFg(dV/dx)。
虽然Newman(2001)是根据溶液中离子的电化学势(μ)来推导离子的移动速率。但是生物材料实验证明,离子选择性微电极的移动距离(dx)在几十微米以下时,带电粒子运动对电化学电势的影响可以忽略不计,所以离子的移动速率也可以通过Fick第一扩散定律计算出来。
应用选择性微电极进行植物研究的早期工作主要是测定细胞内离子活度(Bowling 1972),随着三维微操纵技术和电脑软件控制技术的发展,选择性微电极技术也得到了快速发展,现在不仅能测定细胞内离子活度(Walker等1995;Carden等2003),而且还能测定到活体植物体器官、组织、甚至细胞表面微量离子以及分子移动的速率。
2在植物营养运输研究中的应用
选择性微电极的出现不仅为研究者提供了快速、灵敏地获得活体植物营养运输信息的途径,而且还能用来获得微小区域不同离子微量的信息。Henriksen和Spanswick(1993)采用NO3-微电极研究大麦根对NO3-的吸收情况时,发现只有用NO3-的预处理才能诱导从0.1 mmol/L的Ca(NO3)2中对NO3-的吸收。当有NH4+和NO3-在一起时,与无NH4+的相比,大麦根对NO3-的吸收减少,而对NH4+的吸收则不受影响(Henriksen等1990)。对于NO3-和NH4+同时供给玉米根(0~3.5 mm)时,NH4+的净吸收比NO3-的净吸收高2倍。当有100μmol·L-1的NH4+时,玉米分生区对NO3-的吸收急剧下降,而且在其他区域下降幅度更大,这说明NH4+的存在会抑制NO3-的吸收(Taylor和Bloom 1998)。Colmer和Blomm(1998)用NO3-、NH4+微电极考查水稻不定根对NO3-和NH4+的吸收情况时,发现NO3-和NH4+在成熟区、分生区与伸长区的吸收之间有差异,距根尖端的1 mm区域对NO3-和NH4+的吸收速率都大,NH4+的吸收速率高于NO3-的吸收速率;相反,在含有厚壁组织纤维的水稻不定根的基部区域(距根尖端21 mm之外),NO3-和NH4+的吸收速率明显较低,因此作者认为厚壁组织的纤维限制了根对NO3-和NH4+的吸收。同样,我们实验室用H+、K+微电极研究沙冬青的幼根不同区域在盐胁迫下H+和K+的进出速率情况时,发现其根冠(0~500μm)和分生区(500~2500μm)H+、K+的外流量也都较基部(大于2.5 mm之外)大得多。选择性微电极测定得到的结果可以说明,根冠和分生区是吸收营养元素的关键部位。
植物体内硝酸盐营养可明显改善植株的生长发育。我国学者用NO3-微电极测定了小白菜、水稻活体细胞中NO3-的活度(贾莉君等2005a,b;尹晓明等2005),因此,NO3-微电极的使用可以为选育氮素高效吸收的植物品种提供电生理指标。
钾是大多数植物活动细胞中含量最高的无机元素,钾在碳水化合物代谢、呼吸作用及蛋白质代谢中起重要作用。另外,钾离子还是调节细胞渗透势、平衡膜电位的最重要组分。钾离子进入还是逸出植物根系表面与外界环境中钾离子的浓度有关。当植物根尖处于低钾(<10μmol/L)溶液中时,用K+微电极可测到K+会从根的分生区和伸长区流出,从而使所处溶液中的K+浓度到50μmol/L(Newman等1987;Ryan等1990,1992)。Ryan等(1992)用Cl-微电极研究小麦对铝敏感和耐铝品种根内Cl-的流动时,观察到在小麦根处于0.1 mmol/L的CaC12(pH4.5)介质中时,Cl-大量地从分生区流人介质中。
以上研究结果充分表明,选择性微电极这种能直接并灵敏地反映植物体特定微区(>um)对矿质元素的需求的测试工具,一方面可供研究者进行某种离子高或低吸收的植物品种筛选,另一方面可供研究者制定出与植物需求相适应的环境营养水平。
3在植物生长发育研究中的应用
光通过光周期和非光周期过程影响着叶片的展开。选择性微电极能探测到光诱导引起的与叶片生长有关的离子或分子信息。Zivanovic等(2005)利用选择性微电极比较了白光(2600μmol·m-2·s-1)下及结合使用DCMU后的玉米叶片不同区域(叶基部和叶顶部)的H+、K+和Ca2+流量,结果表明,去表皮叶片的叶基部和叶顶部离子流量无显著差异,留表皮的叶片的叶基部和叶顶部离子流量有显著差异,并推测,光诱导引起的叶表皮K+流(动)是叶片展开必需的,叶肉细胞K+流的变化可能只是起着平衡电荷的作用;光诱导的Ca2+内流既不直接引起叶片展开,也不直接贡献光合行为表现。该研究表明,选择性微电极探测到的光引起离子流的变化既与叶片生长相联系,也与光合作用有关。更有趣的是,Shabala和Newman(1997a)用H+、Ca2+微电极研究玉米根不同区域的回旋转头运动(circumnution)与H+、Ca2+的流动关系时,发现根伸长区的H+流动与玉米根的回旋转头运动关系密切。认为H+流的振动(oscillation)可能参与了根的回旋转头运动。
菌根是土壤中特有的真菌与植物根的共生联合体。植物有了菌根,就可以通过无数细长菌丝和菌索吸收土壤中的营养和水分,扩大根系的吸收面积,提高吸收能力。选择性微电极可直接置于植物活的外生菌根(ectomycorrhizae)表面,研究单个菌根对不同离子吸收或释放的情况(Plassard等2002)。这为在含有不同离子的土壤上种植喜好该土壤中离子的菌根植物,提供了一种方便快捷的方法。由此看来,微电极技术还可以用来研究不同生活习性的植物根系对离子吸收的嗜好,为不同植物种植于不同离子含量的土壤中提供理论依据。
近几年,选择性微电极技术发展较快,除了能用于测定植物体H+、K+、Na+、Ca2+、Cl-、NO3-、NH4+、Cd2+(Piñeros等1998)、Mg2+(Shabala和Hariadi 2005)离子信息,还能测定O2信息(Xu等2006;Pang等2006;Shabala等2006)。如,Xu等(2006)利用H+微电极和O2极谱电极同时测定了百合花粉管生长过程中H+和O2进出的变化。结果表明,在花粉管碱化区域的H+表现为外流,而O2表现为内流,因此,推测花粉管碱化区域有丰富的活跃的线粒体。
上述研究结果充分说明,选择性微电极技术能单独地用来有效测定植物生长发育过程中所需的各种矿质元素、H+、O2等的含量和它们之间的关系,这对人们研究植物根系的生长及其对土壤中各种营养元素的吸收过程提供了一个极为有效的手段。
4在植物信号转导研究中的应用
Ca2+是植物活细胞信号转导过程的重要第二信使,通过许多种依赖钙的调节蛋白和功能蛋白,钙信使几乎在植物细胞的所有信号转导途径中发挥着重要作用。触摸、病原物侵染、植物激素、逆境(包括盐胁迫、氧化胁迫、低温、高温、干旱等)均能引起胞内Ca2+水平改变。这种变化通过启动胞内生理生化过程,起着传递和放大信号的作用(Bush 1995)。
Bjorkman和Cleland(1991)采用Ca2+微电极测定玉米根尖表面Ca2+的流(动),发现在受重力刺激的根尖内外存在一个Ca2+梯度。该Ca2+梯度似乎具有信号传递功能。随着Ca2+微电极技术的不断应用,人们发现Ca2+流(动)还涉及到植物对各种环境胁迫的反应。如,Huang等(1992)认为Al3+能抑制对Al3+敏感小麦品种对Ca2+的吸收,而不抑制耐Al3+小麦品种对Ca2+的吸收。Halperin等(1997)发现在盐胁迫下大麦根尖对Ca2+的吸收下降,而其他区域则不下降。Vincent等(2005)比较了野生型和突变体拟南芥根毛外部Ca2+的流(动)情况,发现缺失AtSfh1p的根毛的Ca2+信号传递异常。Felle等(2000)利用Ca2+和H+微电极考查(GlcNAc)n和Nod factors对苜蓿(Medicago sativa subsp.sativa cv Sitel)根毛细胞内Ca2+和H+活度的变化及细胞防御反应的关系时,发现(GlcNAc)n和Nod factors与根毛共生及防御相关的信号感受位点不同,而且由它们引起的胞内Ca2+活性或者pH的变化及其下游响应也不一样。
Shabala和Newman(1997b)用H+微电极测定了对骤冷敏感的黄瓜、南瓜,不敏感的豌豆,蚕豆及中度敏感的玉米等5种作物根表面H+的运输情况,观察到经过4℃冰箱冷胁迫处理1.5 hr的植物根系表面的H+,开始几分钟都表现为外流,只是耐冷的豌豆和蚕豆的H+外流持续时间短些(3~4 min),而冷敏感的黄瓜和南瓜的H+外流持续时间长(8~12 min),而且耐冷的豌豆和蚕豆的ACT1(associated with H+minimum)和ACT2(associated with H+maximum)显著的低于冷敏感的黄瓜和南瓜的。并认为离子流(动)的进一步研究也许能指明胞内感受骤冷胁迫的位点及其信号传导途径。
Hanstein和Felle(2002)用Cl-微电极研究观察了CO2对蚕豆保卫细胞及其质外体中的Cl-活性。结果表明,CO2浓度从350μl/L增至600μl/L时,质外体的Cl-活性在10 min内就从3 mmol·L-1增加到14 mmol/L,这表明大量Cl-从保卫细胞流出。这种Cl-反应与关闭光源所引起的Cl-外流相似。CO2引起的Cl-外流暗示有一个来源于CO2的中间效应器,它能激活保卫细胞原生质膜上的阴离子通道,从而引起Cl-外流。Tegg等(2005)利用非损伤离子流测定技术探测到了植物组织(根、花粉管)因使用thaxtomin A(一种植物毒素)而引起的Ca2+和H+流量变化,并认为具有组织特异性的Ca2+、H+流量的快速变化,是thaxtomin A引发的早期信号,是植物感知病原体的关键方式。
上述结果说明,超灵敏的选择性微电极可以应用于离子的极微量变化的信号探测。
5在植物逆境生理研究中的应用
随着选择性微电极技术的日益成熟,近年来,许多学者开始用选择性微电极探讨植物适应逆境的离子或分子流的瞬间变化(我们称之为原初响应机制)。Shabala(2000)考察了蚕豆叶片叶肉细胞在盐胁迫和渗透胁迫下离子流的响应机制,观察到90mM NaCl会导致K+出现明显的外流,促进H+泵活性,但是当测定液中含有10mM Ca2+时,上述现象就不发生。然而Na+流无论在高Ca2+或低Ca2+的测定液中,变化都不明显。相反地是,蚕豆叶片在150mM甘露醇(相当于-0.38 MPa)下,K+出现明显的内流。因此,Shabala认为蚕豆叶参与感知盐分和渗透胁迫的离子响应机制是不同的。而且他们还发现,所处测定液的离子组成的变化并不会改变渗透胁迫(150mM甘露醇)引起叶肉细胞K+、Cl-显著的增加(Shabala等,2000)。另外,shabala等(2002)把选择性微电极技术和压力探针技术结合起来,直接观察到了渗透胁迫时拟南芥根表皮细胞膨压变化与离子移动之间的关系,实时地证明了渗透胁迫一开始,细胞膨压立即从0.65 MPa降低到大约0.25 MPa。当胁迫2~10 min左右时,细胞膨压开始恢复,而且此时伴随着K+、Na+、Cl-的显著内流(30~80 nmolm-2s-1),并认为细胞膨压的快速恢复主要是由于渗透胁迫引起大量K+、Na+、Cl-调入细胞,从而加大吸水能力。
Carden等(2003)在测定200 mmol/LNaCl胁迫下小麦根内Na+、K+、H+活度的变化时,将微电极分别插入根皮层细胞的胞质里和液泡里,测定了这两部分Na+等离子在200 mmol/LNaCl胁迫下第5、8天发生的变化。结果表明,NaC1胁迫处理后的第5天,大麦耐盐品种‘Gerbel’和盐敏感品种‘Triumph’根皮层细胞胞质都具有较高K+活度,而细胞胞质中的Na+活度则是盐敏感品种明显高于前者;NaC1胁迫处理第8天,耐盐品种根细胞胞质仍能维持高K+活度,而盐敏感品种的K+活度下降,Na+活度则‘Gerbel’细胞胞质中高于‘Triumph’。Pang等(2006)用选择性微电极研究了耐涝大麦与涝敏大麦在水涝(即氧不足)条件下,大麦根三个区域表面的H+、K+、O2流(动)。发现涝敏大麦‘Naso Nijo’在氧不足时,其根成熟区表面的K+内流量急剧变小,而耐涝大麦‘TX9425’K+内流量几乎未发生变化。
当用选择性微电极进行长时间监测时,还可以观察到植物体的离子或分子流呈现一定的次昼夜节律性波动变化。Shabala等(2006)用H+、K+、Ca2+、O2微电极分别考查了多种植物及同一植物不同部分(燕麦胚芽鞘原生质体、番茄花粉管、原生生物细胞、玉米幼根分生区、玉米叶表皮)的H+、K+、Ca2+、O2流(动)。观察到H+、K+、O2流(动)具有内生的波动节律性变化,Ca2+流(动)却没有波动,而且H+、K+、O2流次昼夜节律性波动的周期会随着环境温度、氧浓度、试验植株生长的基液的化学组成、盐和渗透胁迫的变化而变化;跨膜的H+流的波动周期随着试验植株所处的基液中K+、NaCl浓度的升高而增大,随着环境温度上升而减小;O2流的次昼夜节律性波动随着环境温度下降、氧不足而变慢。
上述研究充分说明,选择性微电极技术可以及时准确地检测到活体植物离子或分子信息因环境变化而引起的微量变化。因此,该技术可能成为最灵敏、最直观、能实时反映逆境胁迫后植物的生理指标测定方法之一。
6选择性微电极技术的优点与局限
选择性微电极技术的最大优点,是在保持被测植物样品完整(即不造成任何损伤)和接近实际生理状态环境下进行测定,并能实时、连续地获得进出活体植物组织、器官、单个细胞甚至细胞器内特定离子或分子活度计移动速率。虽然膜片钳技术也能实时监测植物生物膜离子通道的离子(电)流(ion current)变化,但是它只能用于研究脱去细胞壁后的生物膜的离子通道(电)流(许越和邱泽生1993;朱俊英等2006),使得它在植物上很难广泛应用。当然,现在也有研究者把选择性微电极技术与膜片钳技术结合起来,同时监测生物膜的离子流(动)(ion flux)和离子(电)流(Tyerman等2001;Gilliham等2006),这为实时探明不同环境下生物膜离子通道、载体或泵活性的变化提供了很好的研究平台。选择性微电极技术与膜片钳技术及常规技术相比具有明显的优点,上述3种方法在测定离子流时的差异见表1。

当然,目前选择性微电极技术也有制作困难,且不易保存,离子载体或LIX的选择性系数不理想(Knowles和Shabala 2004),且选择性微电极所测到的电位与溶液的浓度并不总是呈现理想的能斯特斜率(Nernstian slope),另外膨胀状态的植物细胞及其细胞壁,容易损坏微电极的尖端(Felle 1989),因此在一定程度上也限制了其应用的范围。
7展望
选择性微电极技术能用于直接并灵敏地观察植物体对矿质元素的需求,研究者可利用选择性微电极技术进行对植物某种离子或高或低的吸收的品种的筛选,还可制定出与植物需求相适应的环境的营养水平;能及时准确地探测到的光、温、水涝、盐分引起的植物体离子或分子信息的微小变化,能成为预测植物受到逆境胁迫最直观、最灵敏的生理指标测定方法之一;超灵敏的选择性微电极可以应用于信号传递过程中有关离子或分子的微量变化的信号探测;还可用于基因组后期研究所面临的那些未知的或者人工表达的蛋白质功能的研究鉴定,等等。
近年来,在分析化学上对离子选择电极取得了很大进展,测定下限得到了很大提高,如Ca2+等可以达到10-9 mol/L水平(Michalska 2006),以及光纤维微电极的发展(Wolfbeis 2006)、纳米微粒传感器的进展,特别是碳纤维微电极伏安法的进展为细胞生物化学物质的交换等研究产生重大影响。选择性微电极技术在测定植物体内信号物质(如NO、H2O2、CO),磷酸盐和Cu2+、Zn2+等微量元素也取得一些新的进展(Bakker和Qin 2006),使该方法在植物生理上的研究日益完善。
总之,由于选择性微电极技术是非损伤性地分别记录活体植物细胞表面的离子或分子移动的原初响应机制,能让研究者在真正意义上实现与活体植物器官不同细胞的直接对话,能让研究者实时了解植物体随环境变化发生的变化及植物(细胞)所做出的反应诱发所做出的反应的原因。随着旭月(北京)科技有限公司将“非损伤微测技术”引进到国内,选择性微电极理论研究的深入和探测技术的不断发展,必将更准确、更全面地揭示植物体离子、分子信息与植物特定功能之间的关系,为国内植物生理研究者揭示植物体内在的生命活动规律提供较好的技术手段。
致谢:北京林业大学尹伟伦院士对本文的热情支持和指导。
 相关新闻
相关新闻