热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
随着人口老龄化、心血管疾病危险因素以及缺血性心脏病治疗方法的增加,全球心力衰竭患者的数量已从1990年的3350万增加到2017年的6430万,几乎翻了一番。尽管在药物治疗和临床指导性治疗心力衰竭患者方面都取得了重大进展,但与心力衰竭相关的发病率和死亡率仍然居高不下。因此,心力衰竭的治疗亟需治疗新概念和新策略。硫化氢(H2S)是一种新型气体信号分子,在心血管系统中发挥着重要的保护作用,目前已有多种硫化氢供体正处于临床实验。
越来越多的研究发现,H2S可直接通过S-巯基化目标蛋白而发挥调控作用,巯基化修饰方式能快速、精确地调节细胞信号传递。尽管H2S与线粒体功能已有多篇文章报道,但在心力衰竭的发展过程中,H2S是否直接参与线粒体动力学调控及其分子机制仍未阐明。动力相关蛋白1(Drp1)能通过多种不同的方式被激活来驱动线粒体分裂。之前的研究发现,过量的脂质摄取增加Drp1活性,导致线粒体过度分裂和心脏功能障碍(PMID:31896304)。然而,H2S是否直接靶向修饰调节Drp1活性进而发挥心脏保护作用尚不清楚。近日,上海大学呼庆勋课题组在Redox Biology在线发表了题为“CystathionineγlyaseS-sulfhydrates Drp1 to ameliorate heart dysfunction”的研究论文,发现CSE/H2S通过巯基化Drp1的半胱氨酸607阻止Drp1过度活化、线粒体移位以及与VDAC1的相互作用,进而缓解线粒体功能障碍和心肌细胞凋亡,表明靶向Drp1硫巯基化是一种潜在地改善心力衰竭的有效途径。
Unisense微呼吸系统的应用
Unisense微呼吸系统用来评估CSE/硫化氢通过巯基化Drp1改善心脏功能障碍效果。通过向微呼吸瓶中注入组织样本,并添加L-半胱氨酸(底物)和磷酸吡哆醛,实时监测H2S的产生。unisense微呼吸系统可以获得在不同发育阶段和不同组织中H2S产生的动态变化。通过添加Drp1,一种CSE抑制剂,能够确定CSE对总H2S产生贡献的比例。
首先,研究者发现小鼠CSE基因(心肌细胞中重要的H2S合成酶)的缺失(CSE KO)会对小鼠心功能紊乱的发生和心肌病理重塑产生影响,例如射血分数和缩短分数显著下降,左心室舒张内径和左心室舒张末期容积显著增加等。相反,CSE过表达(CSE OE)可以改善异丙肾上腺素(ISO)诱导的小鼠心力衰竭,这说明H2S在心功能调节中起着重要作用。
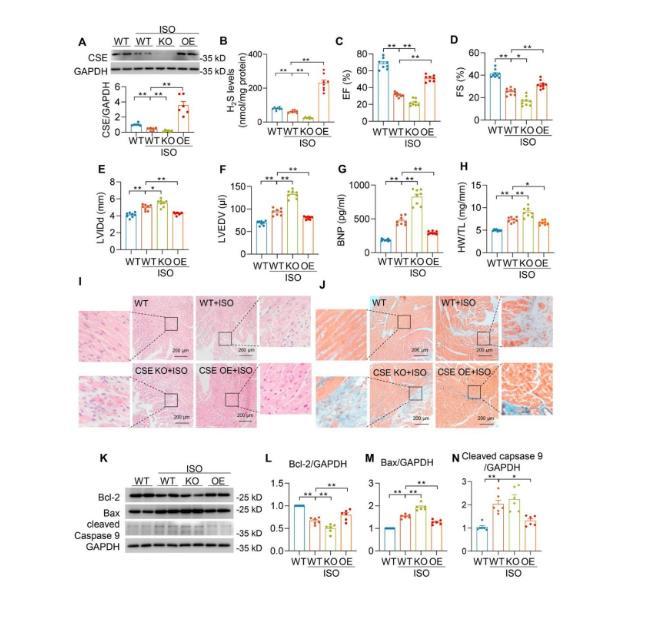
此外,随着心力衰竭的进展,CSE KO小鼠发生了更严重的心肌肥厚、心肌组织纤维化和细胞凋亡,而CSE OE则显著降低了心衰引起的不利影响。这提示CSE/H2S通路介导了慢性β肾上腺素能受体激活过程中小鼠心功能紊乱的发生和心肌组织病理重塑。随后,研究者探究了H2S对线粒体形态调节的作用机制。研究者发现在CSE KO-ISO心脏中Drp1活性增强,而在CSE OE-ISO心脏中Drp1活性恢复,提示H2S抑制了Drp1的活性。Drp1从细胞质到线粒体的转移受多种信号和翻译后修饰的调节,这其中Drp1的丝氨酸616(S616)磷酸化促进其移位,而Drp1的丝氨酸637(S637)磷酸化则抑制其移位。实验数据显示,在CSE KO-ISO心脏中,S616处Drp1磷酸化水平较高,S637处Drp1磷酸化水平较低。然而,这些变化在CSE OE-ISO心脏中减弱。
此外,Drp1多聚体(Drp1活性的表现形式)也受到了H2S的调节。这些结果表明,H2S在心力衰竭时调节Drp1的磷酸化、移位、多聚体形成和GTPase活性。蛋白质硫巯基化是一种新的蛋白质翻译后修饰方式。为了探讨S-巯基化是否与调控Drp1活性有关,研究者比较各组Drp1的S-巯基化水平。
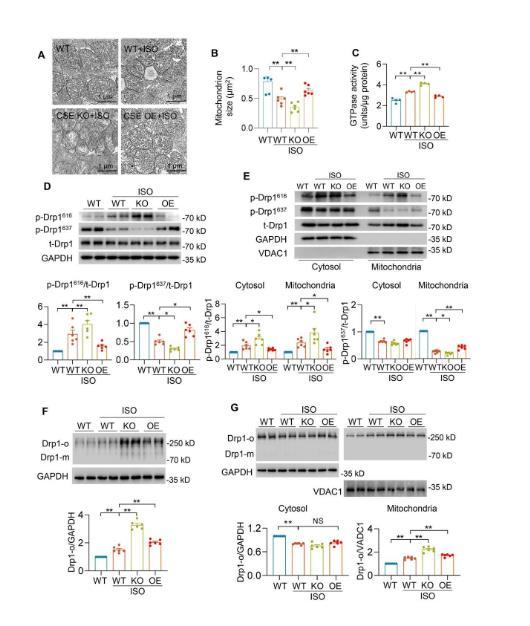
结果发现,WT-ISO心脏和线粒体中Drp1的S-巯基化水平显著降低,CSE KO进一步下调了Drp1的S-巯基化水平,而CSE在整个心脏或线粒体部分过表达增强了Drp1的S-巯基化水平。此前有报道一氧化氮(NO)S-亚硝基化Drp1,促进线粒体分裂,但S-亚硝基化与Drp1的S-巯基化之间的调节关系仍不清楚。为进一步探索可能的潜在机制,研究者检测了心脏中诱导型一氧化氮合酶(iNOS)蛋白水平,发现WT-ISO和CSE KO-ISO心脏的iNOS蛋白水平显著增加,然而CSE OE-ISO心脏的iNOS蛋白水平有所减少。这些数据提示,H2S参与iNOS途径的调控。此外,增加H2S水平显著减轻了Drp1蛋白的S-亚硝基化。在体外蛋白水平或者细胞中直接抑制iNOS活性,H2S仍能抑制Drp1的S-亚硝基化并促进Drp1 S-巯基化。
这些结果表明,H2S直接与NO竞争性修饰Drp1。接着,研究者通过突变9个Drp1半胱氨酸明确S-巯基化的半胱氨酸残基位点。H2S增强了WT Drp1以及除C607A外的大多数点突变的S-巯基化,表明C607是发生S-巯基化的残基。C607在不同物种间的GED结构域中高度保守并处于活性的关键位置,H2S可能通过调节Drp1的结构构象而激活Drp1活性。为了验证这一假设,研究者检测了在ISO刺激下Drp1磷酸化水平。在Drp1 WT和大多数Drp1突变体中Drp1磷酸化水平增强,而Drp1 C607A的突变显著抑制了Drp1磷酸化。这些实验表明,C607被特异性S-巯基化,是Drp1活化的关键残基。为了进一步证明S-巯基化Drp1的半胱氨酸607在调节Drp1活性和功能方面起着至关重要的作用,研究者构建了Drp1 WT(Ad-Drp1 WT)和Drp1 C607A(Ad-Drp1 C607A)的腺病毒,并感染至成鼠心肌细胞,发现Drp1的表达和活性并未受到影响。
随后,研究者检测了Drp1 C607硫巯基化水平,发现NaHS处理的Ad-Drp1 C607A过表达的心肌细胞中几乎未发现S-巯基化。在ISO处理的Ad-Drp1 WT过表达的心肌细胞中,Drp1的S616磷酸化和GTPase活性显著增强。为了进一步展示线粒体形态变化,研究者构建了含有GFP-Drp1 WT(Ad-GFP-Drp1 WT)和GFP-Drp1 C607A(Ad-GFP-Drp1 C607A)的腺病毒。H2S能够抑制ISO引起的成鼠心肌细胞线粒体过度分裂。但是,H2S孵育并没有消除ISO诱导的Ad-GFP-Drp1 C607A过表达的心肌细胞的线粒体分裂。这些结果表明,Drp1 C607是心肌细胞中Drp1激活的关键位点。为了进一步探索Drp1 C607在体内的重要作用,研究者将Drp1及其突变体病毒原位注入心脏,并利用主动脉狭窄术构建心力衰竭模型,发现Drp1 C607A过表达显著降低了Drp1的S-巯基化和亚硝基化水平。同时,Drp1 C607A过表达加速线粒体分裂、减低心脏收缩功能、加重细胞凋亡,显著抑制了H2S对心脏的保护作用。最后,研究者探究了S-巯基化Drp1下游分子机制。电压依赖性阴离子通道1(voltage-dependent anion channel1,
VDAC1)在细胞凋亡中起重要作用。研究者发现,ISO增强了心脏中Drp1与VDAC1的相互作用。CSE KO进一步增强了Drp1与VDAC1的相互作用,而CSE OE抑制了这种作用,Drp1 C607A抵消了H2S作用,表明S-巯基化修饰调节Drp1与VDAC1的结合。H2S和VDAC1抑制剂(VBIT-4)均能阻断Drp1 WT过表达的成鼠心肌细胞中ISO诱导的mPTP开放、ATP水平下降和细胞凋亡,但这些影响能被Drp1 C607A过表达所阻断。
此外,线粒体NADH/NAD+比率是线粒体功能的关键指标,研究者利用之前发明的遗传编码荧光探针mt-SoNar(PMID:34901920),实时展示了线粒体NADH/NAD+比率的波动,更加直观、精准、原位呈现线粒体功能变化。综上所述,该研究发现了一种新型的Drp1翻译后修饰形式,该修饰在体内外对异常线粒体分裂和心脏功能有保护作用。硫巯基化Drp1的半胱氨酸607调节Drp1磷酸化、GTPase活性以及与VDAC1的相互作用,从而改善线粒体功能和心肌细胞凋亡。
这些结果首次证实了Drp1的S-巯基化介导心脏线粒体功能。基于以上研究结果,通过靶向Drp1 S-巯基化并维持线粒体形态的干预措施可能是一种潜在地治疗心力衰竭的新策略。上海市同济医院武丹副主任药师为本论文的第一作者,上海市曙光医院谭波副研究员和上海大学研究生孙媛媛做出了重要贡献,上海大学呼庆勋副教授是通讯作者。该工作得到国家自然科学基金、上海市自然科学基金、上海市浦江人才计划和上海市晨光计划等科研项目资助。