热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
3.1.轴向氧分布
氧浓度(以氧分压表示)表明,台湾褐飞虱肠道系统的不同部分存在显着差异(图2)。在前肠,记录的氧气浓度为3.8±1.1 kPa,这表明氧气水平相对较低。对于拉长的中肠,中肠前部、中部和后部的氧浓度分别增加到7.3±1.9、4.7±2.0和7.2±3.3 kPa。然而,从中肠到前腹部的氧浓度水平急剧降低,这导致了台湾褐飞虱后肠正中腹部的完全缺氧环境。
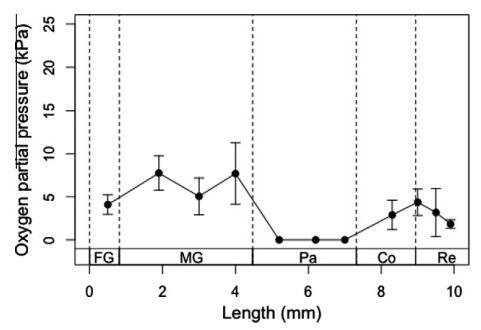
图2。台湾褐飞虱肠道系统的轴向氧分布。氧气数据记录在一个肠道隔室的中心。剖面图上的每个点代表五次单独测量的平均值±SE。
3.2.径向氧分布
在这项研究中,还测量了台湾褐飞虱肠道系统中从肠壁到肠室中心的径向氧分布。与肠道系统的其他隔室(如中肠和后肠)相比,台湾褐飞虱的前肠表现出相对缓慢的径向氧浓度下降;当微电极尖端到达前肠腔中心时,氧气浓度最终接近于零(图3A)。相比之下,台湾褐飞虱中肠中的氧含量从肠壁到管腔中心迅速急剧下降(图3B)。然而,台湾褐飞虱中肠中心的氧分压并未降至零。在台湾褐飞虱的后肠中,腹部和结肠区域表现出强大的氧吸收能力,尤其是前腹部,在完全缺氧的微环境中,从肠壁表面到中心的氧水平下降最为剧烈(图3C)。3.3.轴向pH值分布图4显示了台湾褐飞虱肠道系统不同部分的轴向肠道pH值分布,其中沿肠道检测到的pH值范围很窄。前肠的pH值为6.3±0.1。台湾人中肠前部、中部和后部的pH值分别略有下降。然而,在台湾褐飞虱后肠的腹部区域,在中肠-后肠的连接区域,pH值开始增加几乎一个pH单位;这种趋势持续下去,后肠前部和中部的pH值分别显著增加至7.1±0.0和6.7±0.0。如图4所示,测得的最高pH值在后肠的后腹部,其值高达7.3±0.0,但随后在直肠区域以1–1.5 pH单位急剧下降。
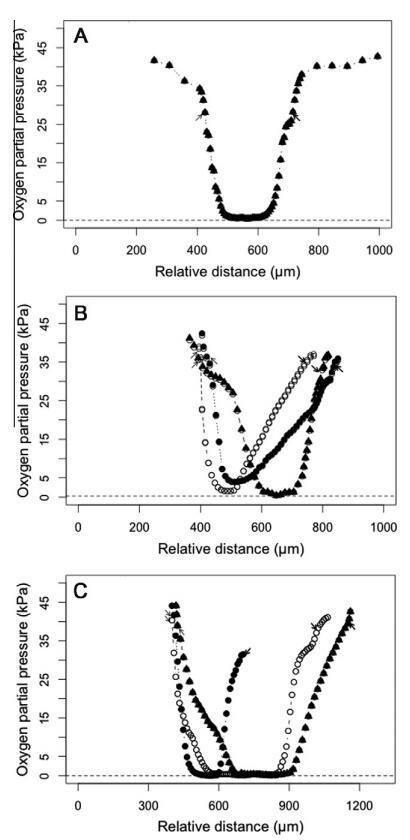
图3。台湾褐飞虱肠道主要隔室的径向氧分布。图中非粗体箭头表示带有测试头的肠管上的起点,在该起点处,从肠壁开始读取有关氧气水平的读数;粗体箭头表示在肠管另一侧终止试验的位置。(A)作物的氧气分布图;(B)中肠前部(d)、中部(d)和后部(s)区域的氧气分布图;(C)显示了后肠前腹(d)、后腹(d)和结肠的氧气分布。从四到七个重复中选择典型的图谱。
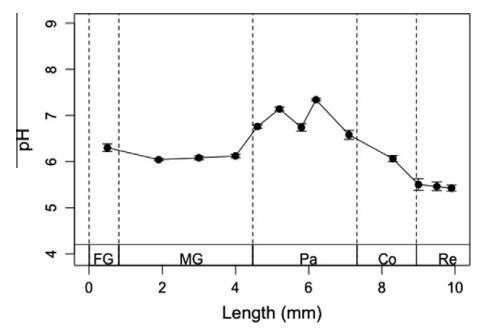
图4。台湾褐飞虱肠道系统的轴向pH分布。所有值均在肠腔中心测量,并以五个独立轮廓的平均值±SE表示。
3.4.氧化还原电位曲线
台湾褐飞虱每个肠道区域中心记录的氧化还原电位范围为+310±30 mV(在作物中)到+70±30 mV(在前腹部)(图5),这表明肠道系统不同位置的氧化还原电位具有较高的动态性。如图5所示,前肠具有最高的氧化还原电位。在中肠,前肠的氧化还原电位略有下降,前肠、中肠和后肠区域的波动较小。此外,在+70±30 mV时,在肠道系统的前腹部记录到最低的氧化还原电位。在结肠和直肠区域,氧化还原电位恢复到较高值。
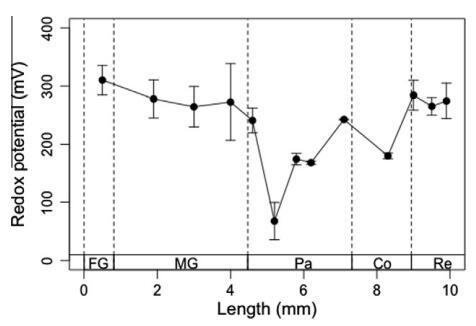
图5。台湾褐飞虱肠道系统轴向氧化还原电位分布。氧化还原电位数据记录在肠道隔室的中心。剖面图上的每个点代表五次单独测量的平均值±SE。
3.5.氢分布
作为白蚁肠道共生体代谢的中心中间体,还记录了台湾白蚁肠道系统的轴向和径向氢浓度分布。氢微电极测量显示,在各种肠道腔室的中心,氢分压范围很广(图6A)。在前肠,氢分压始终低于检测限。对于中肠,氢压分别在前肠、中肠和后肠区域显着增加。氢在后肠前腹部积聚,导致最高氢分压为9.4±0.5 kPa。然而,从前腹部到中腹部的比例急剧下降,在后腹部和结肠中也有类似的趋势。除前腹部外,只有直肠有氢积聚,观察到相对较高的氢分压约为2.5±0.1 kPa。
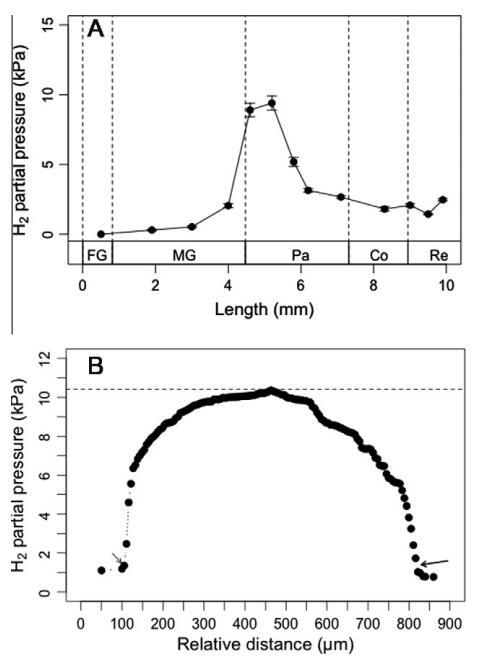
图6。台湾褐飞虱肠道系统中的氢分压:肠道室中心记录的轴向剖面(A)(剖面上的每个点代表五次单独测量的平均值±SE),以及从五个重复中选择的在腹部前部记录的典型径向轮廓(B)(图中非粗体箭头表示带有测试头的肠管上的起点,从肠管壁开始读取有关氢水平的读数;粗体箭头表示肠管另一侧终止测试的位置)。
图6B所示为台湾褐飞虱前腹部氢分压的典型径向分布。最高氢分压(10.4 kPa)记录在肠腔中心,而朝肠壁的氢分压值较小(1.2 kPa)。
3.6.金属离子分布
在这项研究中,共有13种金属离子及其在台湾褐飞虱不同肠道室中的分布情况,以及相关的巢穴共生真菌梳和巢穴土壤样本分别通过ICP-MS进行了测量。如所示,每种金属浓度及其在前肠(作物部分)、中肠、,和后肠(腹部/结肠部分)不同,有六种金属离子,K、Mg、Mn、Ba、Se和Mo,显示出显着差异(P<0.05)(参见,每种相关金属浓度的P<0.05)。其他金属离子在不同位置的浓度没有显着差异。六种金属离子(钾、镁、锰、钡、硒和钼)的浓度存在显着差异,其中五种金属离子(钾、镁、钡、硒和钼)在前肠作物区的浓度最高。锰的最高浓度记录在后肠的腹部/结肠区域。
表1台湾白蚁不同肠道间隔、巢穴共生真菌梳和巢穴土壤样本中记录的金属离子剖面图。
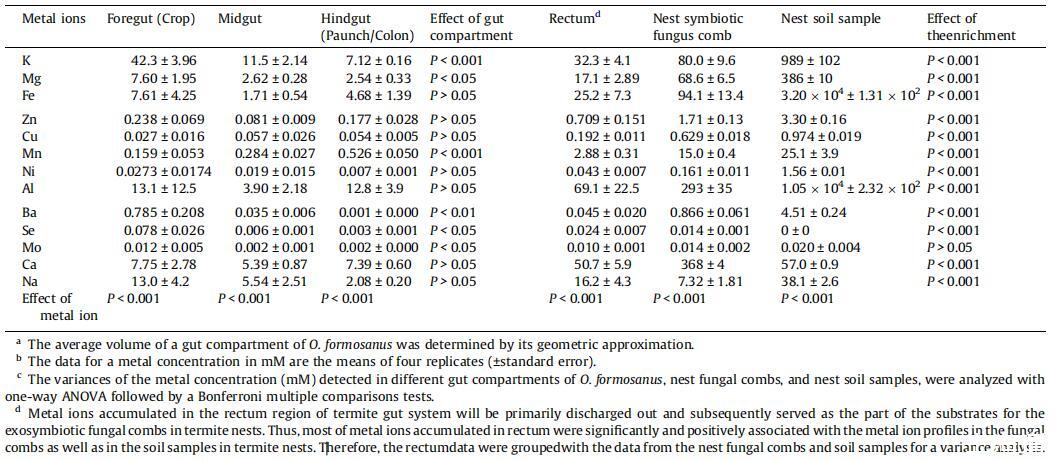
在前、中、后肠微环境中,在台湾褐飞虱消化室的每个位置观察到的13种金属离子的相对丰度分别显着不同(P<0.01)。如图所示,K是存在于前肠、中肠和后肠的13种金属离子中的主导离子。有趣的是,铝在后肠的浓度最高。金属离子的最低浓度出现在前肠、中肠和后肠,通常记录为钼(℃)。
直肠区域是白蚁肠道系统的最后一个隔间,在维持金属离子浓度平衡方面起着重要作用。任何累积的金属离子,连同直肠中的其他未消化物质,最终会作为粪便排出消化道。这随后成为巢穴共生体的独特基质。因此,在直肠、真菌梳和白蚁巢穴中的土壤样本中,除钼外,每种金属都检测到显着的富集效应(P<0.001)。与台湾褐飞虱前肠、中肠和腹部/结肠中的金属离子分布相似,在直肠、巢穴共生真菌梳和白蚁巢穴土壤样本中观察到的每种金属离子的丰度也显着不同(P<0.001)。
生长真菌的白蚁O.formosanus的物理化学条件和金属剖面实际上反映了这种食木白蚁独特的食物加工机制,以及它对木质纤维食物消化的适应能力。我们的研究结果表明,这种白蚁可能确实会改变其肠道的物理化学条件,因为其巢穴中与一种木材降解真菌存在独特的外共生关系,这种真菌有助于白蚁消化食物和进行其他必要的代谢。
台湾褐飞虱肠道系统中的低氧水平表明,由于主要由在白蚁巢穴中培养的外共生真菌提供的帮助,白蚁肠道中的木质素降解水平较低(Li等人,2012)。众所周知,氧与白蚁肠道系统中木质素降解和木质素衍生的芳香代谢物密切相关(Brune等人,1995b)。在以木材为食的低等白蚁中,台湾白蚁和黄鳍网纹白蚁前肠的氧分压分别为30和26 kPa,而中肠的氧分压,在41和32千帕(Brune等人,1995a;Ke等人,2010年)下,它可以达到更高的氧气水平,以满足主要发生在中肠室的木质素氧化过程的需要(Ke等人,2010年)。在非真菌生长的高等白蚁中也报告了类似的情况,例如lujae鼻白蚁,其前肠和中肠的含氧量在40到50 kPa之间(Brune等人,1995a)。值得注意的是,在这些白蚁肠道系统中也检测到漆酶,这意味着木质素改性/降解的耗氧氧化过程(Coy et al.,2010)。相比之下,目前的研究清楚地表明,台湾洋刀豆在其肠道系统中的氧气水平显著较低,介于0到8.6 kPa之间,这表明台湾洋刀豆肠道系统中木质素成分的氧化活性水平较低。这种适应,即台湾褐飞虱肠道系统中的氧气水平较低,可能主要是由于其巢穴中的真菌分解菌白蚁与外共生关系,这与木质素降解过程有关(Ohkuma,2003;Taprab等人,2005)。
中性pH值不仅在生长高白蚁的真菌台湾白蚁的当前消化道中,而且在以木材为食的低白蚁的肠道系统中,如黄鳍白蚁,这表明,一些食木白蚁可能需要肠道系统中的中性pH微环境,以便有效或优化酶降解难降解木质纤维基质的过程。据报道,在以木材为食的低等白蚁中,用微电极系统记录了黄胸鼠消化道中的中性pH微环境(pH 7)(Brune等人,1995a)。在pH值为7时,发现台湾侧柏和黄胸侧柏的重组纤维素酶和天然纤维素酶的活性最高,表明这种中性pH值是这些白蚁肠道系统中纤维素酶功能的最佳条件(Scharf et al.,2010;Zhang et al.,2010)。根据Liu等人(2011年)的说法,从真菌生长白蚁Anandalei的肠道微生物DNA中提取的重组木聚糖酶在pH 7.5时表现出最大的酶活性,表明中性pH环境可能支持木聚糖底物上的最佳水解活性。此外,接近中性pH的反应条件有利于微生物发酵。因此,在白蚁肠道系统中发现的中性pH值很可能为有效的木质纤维素消化提供了最佳pH条件。
然而,在非真菌生长的高等白蚁中,据报道,黑鼻白蚁和微小白蚁的肠道微环境呈碱性(pH>10)(Brune等人,1995a)。此外,在以白蚁为食的土壤中,极端碱性pH值(11–12.5)也是处理腐殖质和土壤食物基质的独特肠道pH环境(Brune和Kühl,1996;Kappler和Brune,1999)。还值得注意的是,肠道pH值是进化适应的结果,以应对各种食物基质加工、各种肠道共生功能以及木质纤维素分解酶的最大活性(Kappler和Brune,1999;Lemke等人,2003;Zimmer和Brune,2005;Zimmer和Topp,1997)。
在不同白蚁物种中报告的各种肠道氧化还原电位可能归因于其独特的食物基质以及适应特定食物和后续代谢的独特机制(Sugimoto等人,1998年)。与目前对台湾白蚁的研究相比,黄鳍白蚁是一种较低等的白蚁,它在中肠(+70至+200 mV)和后肠(200 mV)的氧化还原电位值都要低得多(Ebert和Brune,1997)。据报道,以土壤为食的白蚁Cubitermes spp.的氧化还原电位在中肠表现出相对较高的值(+380至+400 mV),在后肠表现出相对较高的负值(–100至–200 mV)(Kappler和Brune,2002)。值得注意的是,在pH值、氢分压和氧分压相似的情况下,台湾褐飞虱的腹部比黄鳍褐飞虱的腹部更具电正性。似乎可以得出这样的结论:食物基质中的有机和无机成分对肠道的氧化还原电位有显着影响,这一点得到了以土壤为食的白蚁和以木材为食的白蚁之间差异的支持(Kappler和Brune,2002)。为了解决这种可能性,我们比较了在地面上觅食和在巢中生活的台湾白蚁的工作白蚁的氧化还原电位,它们的年龄和大小相同,但肠道内的食物基质不同。结果表明,觅食的工蚁比巢中的工蚁表现出更多的电负性(数据未显示)。因此,真菌菌梳中含有大量的氧化还原活性化合物,如铁(III)和腐殖酸(Mishra和Sen Sarma,1980),它们将被巢中的白蚁作为食物食用,并可能导致肠道中的高氧化还原电位。结合上述结果,从台湾褐飞虱中获得的高氧化还原电位值可能与其独特的食物基质和微生物群落特征非常一致,并反映了其肠道微生物群的组成和代谢活性。
由于氢通常被认为是木质纤维素降解的关键中间体(Pester和Brune,2007),台湾白蚁前腹部10.4 kPa的高氢分压似乎反映了这些白蚁消化系统和相关肠道微生物群代谢的特殊模式。相比之下,在以木材为食的黄鳍网纹白蚁和以土壤为食的正颌方白蚁中,氢分压(分别为5和3 kPa)始终低于台湾白蚁(Ebert和Brune,1997)。众所周知,白蚁肠道中氢积累的差异是由于负责制氢和耗氢过程的微生物群落和空间分布的差异(Pester和Brune,2007)。此前对大型白蚁亚科的研究表明,活白蚁的甲烷和氢气排放率较低,并且还原性产乙酰能力较低,这可能意味着台湾白蚁的肠道可能含有较少的氢气消耗者,导致其内脏中大量积累氢(Anklin-Mühlemann等人,1995年;Brauman等人,1992年;Shinzato等人,2007年)。
台湾褐飞虱从肠腔到肠壁的陡峭径向氢分布,以及肠壁附近的斜率,表明肠壁处存在非常强的氢汇。由于台湾O.formosanus肠道中同产乙酰螺旋体的丰度较低(Shinzato等人,2007年),目前尚不清楚哪些潜在细菌会导致肠壁的氢消耗量。需要详细分析台湾白蚁肠道系统中负责产甲烷和还原性乙酰生成的细菌的空间分布和群落结构,这将有助于了解真菌生长白蚁的氢代谢(Brune,2011)。
除了氧气、pH值、氧化还原电位和氢气是白蚁肠道系统中重要的物理化学条件外,一些金属离子确实对维持食品加工过程中的一些关键代谢以及多种肠道微生物群的栖息地至关重要(Kramarz,1999)。从目前的研究中可以清楚地看出,台湾褐飞虱在其肠道系统以及培养的真菌梳子中以高浓度选择性地积累了几种金属离子。这些金属离子可能与木材解构过程以及一些内共生和外共生微生物的功能有关(Mills等人,2009年;Stewart等人,2011年;Yoshimura等人,2002年)。
这些金属离子在台湾褐飞虱肠道系统中分布和浓度的差异表明,某些金属离子可能有助于肠道微生物群落或某些功能,例如激活一些参与木质纤维素降解的酶。本研究结果表明,K、Mg、Mn、Ba、Se和Mo在台湾褐飞虱主要消化道中的空间分布存在显着差异。显然,中肠和后肠中鉴定出的五种金属离子(K、Mg、Ba、Se和Mo)呈现出类似的趋势,其浓度显着低于前肠中记录的浓度,表明这些金属离子的低浓度可能更适合肠道微生物功能和相关酶活性。
此外,有报道称,在白蚁木质纤维素降解系统中,Mg2+是一些木质纤维素酶反应中起作用的重要金属离子之一。1 mM Mg2+导致重组木聚糖酶的活性显着增加,重组木聚糖酶来源于真菌生长的白蚁大白蚁的肠道微生物DNA(Liu等人,2011年)。Mn2+还将显着影响白蚁肠道系统中的酶反应,并可将b-葡萄糖苷酶活性提高150–230%(Jeng等人,2011年)。这与台湾稻瘟病菌的腹部结肠部分的Mn2+浓度显着高于其他肠道部分的情况相符,在那里也观察到b-葡萄糖苷酶的优先富集(Liu等人,2011年)。此外,台湾褐飞虱肠道系统的腹部和结肠部分相对较高的铁浓度可能与氢化酶的活性密切相关,因为肠道微生物群产生的氢化酶需要结合铁才能发挥功能(Ballo和Leadbetter,2011)。除此之外,之前的研究表明,在以木材为食的白蚁和以土壤为食的白蚁中,几种微生物会减少铁(III),这将导致肠道中的铁(II)显着集中。这种现象也在真菌生长的台湾白蚁中观察到(Li等人,正在准备)。铁(III)作为一种潜在的电子库,可能有助于台湾褐飞虱肠道内的微生物代谢和氧化还原电位。
白蚁巢穴中的真菌梳作为一个外共生系统(专性细菌和真菌的栖息地),协助木材预处理,以确保有效分解真菌生长白蚁的顽固性木质纤维食物基质。问题在于白蚁如何能够抑制土壤中或工蚁带入巢穴的其他潜在细菌和真菌。台湾褐飞虱在外共生真菌中优先积累金属离子,这可能会使外共生微生物受到压力,从而保持真菌的无病性。另一方面,真菌中各种金属离子的显着浓度也可能与木质素降解有关。例如,参与非酶芬顿反应的铁是真菌木质素降解的关键(Arantes et al.,2012)。除了铁,其他金属离子,如Ca2+、Mn2+和Cu2+也可能具有类似的功能,以协助生物质转化(Wei等人,2011年;Xu等人,2010年)。然而,还没有关于这些金属离子在肠道系统或真菌梳中的作用的信息报道。
利用微电极系统,系统地研究了生长真菌的台湾白蚁消化道的主要物理化学条件,特别是氧、pH、氧化还原电位和氢的轴向/径向分布。结果表明,台湾褐飞虱具有独特的肠道微环境,其特点是氧气浓度低,pH值中性,氧化还原电位相对较高,氢积累显着,这可能意味着它更适合有效降解木材基质的需要,以及肠道系统中的其他重要代谢产物。此外,该白蚁木质纤维素分解系统中的13种不同金属离子,包括巢穴外共生真菌梳和相关的巢穴土壤样本,均通过ICP-MS进行了分析。结果表明,一些金属离子在高浓度下选择性累积,不仅在肠道系统中,但也存在于真菌梳子和土壤样本中,这可能对木材降解过程中的一些酶反应至关重要。这项研究清楚地扩展了我们对生长真菌的白蚁O.formosanus的特定肠道微环境的了解,并有可能进一步阐明这种以木材为食的高等白蚁的木材分解机制,这种白蚁在其巢穴中生长的共生真菌的独特辅助下分解木材。
我们感谢基尔大学(英国基尔)的法尔科·德里霍特博士改进了我们的手稿。中国自然科学基金(项目编号:31170611)、中国浙江省自然科学基金(项目编号:Z3100211)、江苏高等学校重点学科建设项目资助的课题。
 相关新闻
相关新闻