热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
结果和讨论
实验性OA研究的主要特征
大多数调查仅限于一个个体发育阶段(75%)、一代(96%)、一个因素(72%)、一个季节(96%)、一年(99%),是实验室基于(73%)并以恒定强度(89%)应用治疗(图1)。例如,通过检查对几个个体发育阶段的多因素影响同时对这些性状中的两个(或更多)进行升级的研究非常罕见(见表S1),即327个中的13个(或4%)。
由众多单因素和单目标实验产生的结果无疑在OResearch的“少年”阶段很重要,这塑造了我们对给定pH变化对给定生物或给定亚生物过程的潜在影响的感觉。然而,就地而言,净影响可能会有所不同。例如,压力源在个体发育阶段的影响可能是累加的、协同的或拮抗的(选择性死亡率导致较旧阶段的敏感性降低),并且仅知道pH值对一个阶段的影响给出了不完整的图景。此外,在一年中,多年生物种通常会经历不同的生理阶段,预计给定的pH值水平在不同季节会产生非常不同的影响。此外,原位pH值水平以及许多其他环境变量(Miller-Neilan和Rose 2014)在时间和空间上都是可变的(见下文)。浮游生物或多或少可以被认为是特定水体中的“居民”,除非它们垂直迁移,否则主要会随着时间的推移经历pH值波动。相比之下,当水运动(水流、向上或向下流)通过空间传输这种异质性时,定居的底栖生物会经历时间波动和pH分布的空间异质性。
近年来,人们已经认识到其中的许多缺点。因此,OA越来越多地与其他环境因素相结合(例如Connell和Russell 2010;Connell等人,2013年;Hiebenthal等人,2013年;Duarte等人,2014年),OA效应在几个个体发育阶段被追踪(例如Forsgren等人,2014年)。2013年;Kurihara等人,2013年),因季节而异(例如Miller等人2012年;McCoy 2013年)或跟随了几代人(例如Low-De´carie等人2011年;Lohbeck等人2013年)。然而,与自然栖息地类似的频率和振幅的pH值或pCO2波动如何调节相对于恒定条件的OA影响,实际上仍未得到探索。一个可能的原因是,大多数栖息地不存在对这些原位波动的长期、高分辨率监测。
碳酸盐化学的原位波动
在下文中,我们将展示最近发表的关于不同尺度的空间和时间pH波动的证据。我们将仅简要提及这些波动的驱动因素,因为Waldbusser和Salisbury(2014年)最近对这些因素进行了出色的审查。
总的来说,我们发现了54篇出版物,其中至少有一个碳酸盐化学描述词(pCO2、pH、总碱度、溶解无机碳(DIC)、[CO2](aq)、[HCO3–]、[CO3 2?])进行了原位监测。我们注意到底栖栖息地之间的研究工作存在很大差异。迄今为止,热带珊瑚礁的24项研究(占研究总数的49%)受到了大部分研究关注(表1)。九项研究(占总数的16.5%)代表了对潮间带岩池波动的研究。自1950年代以来,岩石池就被认为是pCO2和O2波动极大的环境(Daniel和Boyden 1975;Truchot和Duhamel-Jouve 1980),并且特别引起了生理学家的注意。海草草甸也只有9项研究(16.5%)代表,考虑到它们的生态重要性,这是一个很小的数字。大多数这些研究是在地中海的Posidonia Oceanica草地上进行的(Frankignoulle和Diste`che 1984;Frankignoulle 1988;Frankignoulle和Bouquegneau 1990;Hendriks等人,2014)。尽管Zosteraceae广泛分布于温带地区(Buapet等人,2013年),但仅发现了一项关于Zosteraceae的研究,并且只有两项研究侧重于Thalassia spp的热带海草草甸。(Yates等人,2007年;Semesi等人,2009年)。海藻栖息地(不包括海带,占总数的11%)以及海带森林(占总数的7%)相对于其生态相关性的研究严重不足。此外,在此背景下的所有海带研究都是在Macrocystis pyrifera栖息地进行的(Delille等人,2000年,2009年;Hofmann等人,2011年;Frieder等人,2012年)。我们没有发现任何关于温带或热带腹足动物或双壳类珊瑚礁(或由热带造礁珊瑚以外的生物形成的任何珊瑚礁)的研究,例如由牡蛎或贻贝形成的珊瑚礁。确认底栖生态学的总体趋势,我们发现研究工作强烈倾向于热带珊瑚礁。
海水pH值可能会在局部范围内(公里到亚毫米)发生生物学改变,尤其是在以海草、大型藻类、贻贝床、珊瑚或其他工程底栖生物为主的沿海系统中(Duarte等人,2013年回顾)。主要机制是微藻和大型藻类在光合作用过程中吸收CO2(或HCO3–),所有生物在呼吸过程中释放CO2,钙化剂在壳形成过程中降低总碱度和释放CO2(例如Hurd等人.2009)。钙化过程中释放CO2的机制如下:HCO3–解离为Hþ和CO3 2?,而后者作为骨架CaCO3不断沉淀,Hþ再次与HCO3结合-并形成H2CO3,随后分解为H2O和CO2(Hurd等人,2009年)。因此,自养生物、异养生物和钙化生物的光合作用、呼吸作用和钙化活动之间建立了微妙的反馈回路平衡。这些过程受生物体的生理状态和能量可用性以及各种非生物因素的影响,例如温度、光和养分的可用性以及水的运动。此外,水运动将不同预处理的水体输送到特定的栖息地,例如通过垂直对流、潮汐、洋流和上升或下降。所有这些因素反过来会随着一天中的时间、天气条件、季节甚至年际而波动,最终导致流入或流出生物体的净碳流量的时间或空间反转,从而导致海水pH值的生物波动。预计这些波动的幅度与生物量与水的体积比呈正相关,与水交换率呈负相关,而频率和幅度在空间和时间尺度上都可能发生很大变化。pH值的生物调节可能足以完全掩盖沿海栖息地海洋酸化的全球趋势(Anthony等人,2013年;Duarte等人,2013年)。
表1.碳酸盐系统自然波动的原位研究数量数据基于54篇出版物(见表S2)。括号中的数字是百分比
大尺度时空波动:年际变化、年代际循环、气候变化
碳酸盐化学的多年变化受到的监测最少。在底栖栖息地进行的长期系泊记录很少,例如珊瑚礁(Drupp等人,2011年,2013年)。这些缓慢的波动可能会受到周期性气候事件的影响,例如北大西洋涛动的变化或厄尔尼诺-拉尼娜序列的变化。pCO2的多年定向变化,如在气候变化过程中发生的(Stocker等人,2013年),不是严格意义上的波动,也不是本次调查的主题。应该提到的是,这种长期变化在小空间尺度(例如,岩石池中-0.039到-0.054 pH单位年?1)可能比公海(-0.0019 pH单位年-1)发生得更快)(伍顿等人,2008年)。
中尺度时空波动:季节
季节性,特别是由于光和温度的变化,对海水化学有很大影响(Frankignoulle和Diste`che 1984;Delille等人2009;Shaw等人2012)。光周期和辐照度的变化影响生态系统的自养与异养平衡,温度影响代谢活动,这两个因素随着纬度的升高而增加。据报道,亚南极地区(凯尔盖朗群岛、法属南部和南极土地)的海带森林(Macrosystis pyrifera)的pCO2季节性变化幅度为,500 matm,冬季的昼夜变化约为夏季的一半(Delille等人,2000年,2009年)。在温带地区,Frankignoulle和Diste`che(1984年)报告了地中海(法国科西嘉岛)海草草甸(Posidonia Oceanica)中pCO2的季节性变化为500平方米。在夏威夷珊瑚礁(瓦胡岛)中,Drupp等人。(2011)发现pCO2的季节性变化幅度为61 matm,季节之间的昼夜幅度没有明显变化。在百慕大附近的珊瑚礁中,Bates和Leone(2001)发现季节性变化为100 matm。
季节性通常还表现为气象事件强度的变化,例如雨和风情(Manzello 2010;Saderne等,2013)。雨季降雨和河流径流增加会稀释海水,从而降低盐度,从而降低海水的总碱度和缓冲能力。在这种情况下,我们预计生物源pH值变化的幅度将最为显着——如果生物体的活动不会因这种潜在的渗透压力而降低(例如,Saderne等人,2013年)。在热带潮湿季节的巴拿马珊瑚礁中观察到了这种影响(Manzello 2010)。缓冲能力降低也可能解释了在半咸水环境(例如Elkhorn河口(Hofmann等人,2011)或波罗的海西部(Saderne等人,2013年)中记录的特别重要的昼夜pH值变化)。然而,在另一个方向上,河流径流引入的溶解有机质负荷可以通过增加碱度来增加缓冲能力(参见Kulin´ski等人,2014年的解释)。除了对缓冲能力的这些影响之外,河流径流还会影响海水温度、注入营养物质(磷酸盐、硝酸盐和硅酸盐)并增加浊度。总之,这些因素的结合会在季节性或风暴事件后影响生物的生物学和海水的化学性质。例如,在一些珊瑚礁中发现了这种情况,那里的碳酸盐化学在大风暴之后发生了变化(Massaro等人,2012年;Drupp等人,2013年)。
由气象学驱动的瞬时上升流是影响沿海栖息地碳酸盐化学及其动力学的另一个重要现象。在上升流期间,温跃层的浅滩给浅海沿岸栖息地带来了更冷、通常更多、pH值和pO2较低、pCO2较高的咸水团。这些水团与大型植物光合作用的相互作用可以在碳酸盐化学的生物成因变化中产生极端变化。Saderne等人证明了这一点。(2013)在季节性上升流到波罗的海西部的大型藻类栖息地期间。在此事件期间,大量海水pCO2从大气平衡(426 matm)增加到1600 matm,同时盐度增加0.2个单位,温度下降0.38C。大量水非生物参数(pCO2、盐度和温度)变化的结合导致昼夜节律pCO2振幅增加到600 matm,并导致0.35个单位的pH值变化的反直觉下降。这些影响不是由于光合作用增强(减少了20%),而是由于CO2、HCO3-2和CO3-2之间的平衡发生了变化。
小尺度时空波动:昼夜循环和日间变化
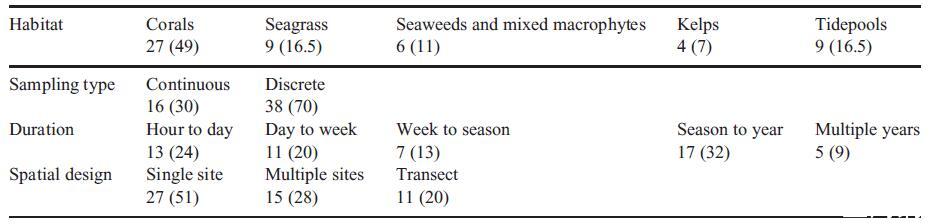
在小型沿海栖息地或浮游生物斑块的昼夜循环中观察到最显着的pH值或pCO2波动模式。在这个小的时空尺度上,振幅很大。这主要是由于24小时内辐照的振荡导致白天通过光养生物高净CO2吸收,这会增加pH值,而所有生物在夜间释放CO2会降低pH值(Koch等人,2013年)。这些昼夜波动的幅度可能因季节而异。例如,在海藻林中,据报道,pCO2在昼夜循环中的变化在冬季为160 matm,在夏季为340 matm(Delille等人,2009年)。同样,温带墨角藻中pCO2的昼夜波动。站在夏末的振幅在240到400 matm之间,秋季可能达到2000 matm(Saderne等人,2013年)。由于天气条件和浮游生物遮蔽,UW辐射的更多短期和零星波动预计会导致大型植物林分中pH值波动的频率和幅度发生相应变化。除了光之外,由于潮汐周期或风事件,海流的速度和方向可能会在一天内发生变化。低流速会降低水体的交换率和稀释度,这应该允许pH值变化幅度更大,而高流速会导致幅度降低。死水的昼夜波动最为强烈,例如,它发生在潮汐池中。在这里,经常发现pCO2的日变化超过1000 matm day?1(Truchot和Duhamel-Jouve 1980;Morris和Taylor 1983;Nguyen和Byrne 2014)。电流速度随着到衬底的距离的减小而减小。Shashar和他的同事(1996)从米的尺度放大到基质上方的微米,区分了三个边界层层:底栖边界层、动量边界层和扩散边界层。底栖边界层是由水与底层浮雕、藻类和海藻冠层或礁石摩擦产生的,尺度从米到厘米(Hurd 2000)。它导致水在底栖生境中的停留时间增加,从而导致碳酸盐化学变化幅度的增加。由基质、植物或无柄底栖动物的地形,以及它们的泵、纤毛或触手活动产生厘米到毫米尺度的动量边界层,产生非常局部的小尺度电流(Shashar et al.1996)。例如,康沃尔等人。(2013)描述了从覆盖有关节珊瑚藻的鹅卵石组合上方10厘米到距藻类表面几毫米以内的pH值日夜幅度越来越宽。在1.5 cm s?1的中等体积水流速下,昼夜条件之间的pH值差异在距离藻类表面68毫米处为0.05,在距离藻类表面6毫米处几乎为0.3。扩散边界层是由于水的粘度在代谢活跃组织表面形成的分子的微尺度浓度梯度。在一项未发表的研究中,我们研究了褐藻Fucus vesiculosus叶状体上方扩散边界层中的pH梯度。我们发现在死水条件下,Fucus叶片表面的暗光pH值波动在几分钟内超过1.0个单位。在增加体积水速度(0、0.5和1.5 cm s?1)下,Fucus vesiculosus thallus的边界层厚度从700毫米减少到200毫米(速度0.5和1.5厘米s?1之间没有差异)和振幅边界层内pH值的暗-光波动减小(图2)。在最接近基质的地方,在停滞条件下pH值波动1.5个单位,在中等水流下波动0.5个单位(图2)。因此,生活在由初级生产者主导的这种微型或纳米栖息地中的生物将经历强烈而快速的pH变化,这可能会在几分钟内H+离子浓度增加或减少30倍(图2)。例如,根据它们的体型,Fucus thallus上的表生生物将在边界层的不同地层中经历不同的波动状态。苔藓虫或幼年藤壶(500毫米高)会受到微弱的pH值波动(0.2单位),并且仅在停滞条件下。许多无脊椎动物(通常高200-250毫米)的新鲜幼虫在停滞条件下会经历强烈的波动(1个单位),而在流动条件下则没有波动。硅藻(1-50毫米)必须承受强烈的波动(停滞时为1.3个单位,流动条件下为0.3个单位)。最后,细菌(0.5-5毫米高)在流动条件下在停滞和中等(0.4个单位)波动下会受到极端波动(1.5个单位)。应该注意的是,这些值是在黑暗和光明之间切换后5分钟测量的。这意味着在停滞条件下,而不是在流动条件下,边界层的厚度可能会随着时间的推移而增加。此外,温度会影响水的粘度和气体的溶解度,从而影响海水的化学性质。例如,在扩散边界层的情况下,这意味着较高的温度会导致较低的粘度,这会导致除停滞之外的所有流态中的边界厚度减小。此外,扩散速率和代谢速率增加,导致在较窄的边界层内总体上出现更陡峭的pH梯度。然而,这仍然需要测试。
到墨角表面的距离(μm)
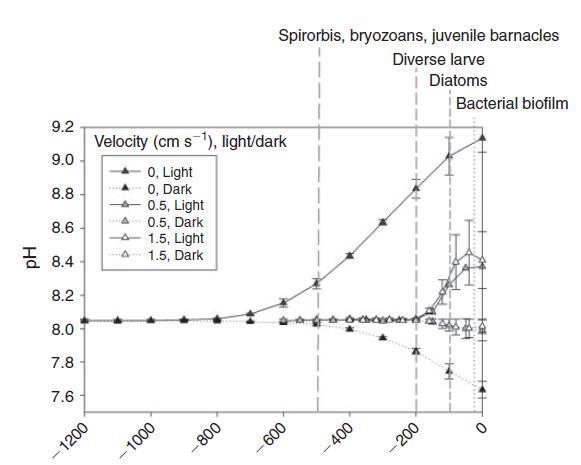
图2.棕色巨藻Fucus vesiculosus叶状体上具有扩散边界层的pH梯度。在测量前5分钟内,允许在明暗条件下以各种体积速度建立扩散边界层。叶绿体表面位于距离=0处,即位于图的右边界处。垂直线描绘了大型藻类叶状体表面(“0厘米”)上方的地层的外部界限,不同的表生生物通常生活在其中。
所描述的pH值的强烈波动可能代表压力阶段和压力释放阶段的交替。直接环境的这种生物不稳定性可能对生理性能有益或有害。它是否有潜力局部调节全球pCO2(OA)稳步上升所施加的假定压力,目前尚不清楚。
空间尺度与效果大小(幅度)之间的关系
鉴于较大水体的惯性越来越大,我们预计生物波动的幅度与空间尺度成反比。珊瑚礁等沿海栖息地的生物碳酸盐化学波动幅度确实与水柱大小和水交换率成反比(Bates和Leone 2001)。例如,Ohde和van Woesik(1999年)在冲绳岛(日本)附近环礁的横断面研究中发现,环礁中心最浅的区域(礁坪)的最大昼夜振幅为927米。潮汐池的水柱高度和交换率降低,是生物活动产生特别强烈的碳酸盐化学变化的栖息地,波动幅度随着海岸高度的增加而增加(Daniel和Boyden 1975)。迄今为止,生物源pH值波动的最大振幅记录在非常小的尺度上(即在亚毫米尺度的底栖边界层中)(Spilling等人2010;Hurd和Pilditch 2011;以及上面给出的例子)。pH值波动的空间尺度、频率和幅度之间的反比关系如图3所示。由于较小的水体具有较小的惯性,因此尺度和变化率不是独立的。事实上,pH变化率与所考虑的空间尺度呈负相关(图4)。最慢的变化发生在公海,在沿海栖息地观察到快速变化,最剧烈的pH值波动来自藻类表面边界层中亚厘米甚至亚毫米的“纳米栖息地”(Spilling等人,2010年;Cornwall等人)2013年)。在开阔的海洋中,浮游生物斑块(Schulz和Riebesell 2013)发生幅度小得多的昼夜和季节性波动,在这种情况下,可以将其视为漂浮的微生境。

图3.pH波动的典型振幅('delta pH')和频率('Time')与所考虑系统的估计大小('Space')之间的关系。数据是从报告原位波动的选定论文中提取的(Morris和Taylor 1983;Middelboe和Hansen 2007;Semesi等,2009;Spilling等,2010;Thomsen等,2010;Hofmann等,2011;Hurd和Pilditch);Frieder et al.2012;Gray et al.2012;Price et al.2012;Cornwall et al.2013;Johnson et al.2013;Melzner et al.2013;Saderne et al.2013;Saderne and Wahl Stock et al.2013;al.2013;Comeau et al.2014;Hendriks et al.2014)以及本文中作者自己的测量结果。需要注意的是,这些文章中的幅度、时间和空间尺度是根据这些文章中的图形和文本信息估算的,仅代表数量级。
波动的生物效应
我们对pH值或pCO2波动的生物学相关性的普遍无知源于前面提到的方法学研究局限性。我们在实验室进行的大部分调查都使用恒定的处理水平。在现场实验中,可以容忍波动,但很少评估它们相对于非波动条件的重要性。在这一点上,重要的是要注意恒定和波动条件不是两个离散条件。相反,“恒定性”代表连续体上的一个点,其中变量波动的频率相对于生物体的生物节律较长,或幅度接近于零。
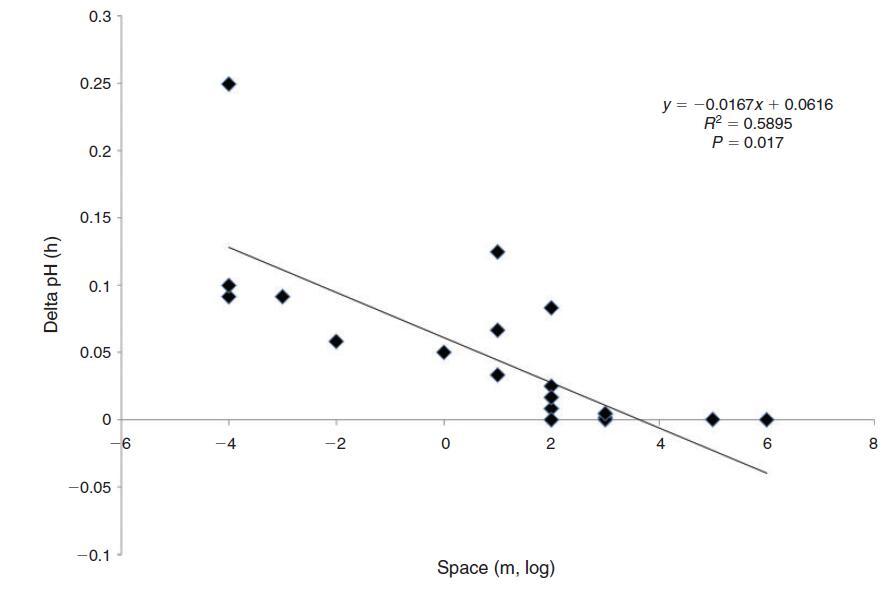
图4.不同空间尺度下pH值的变化率。考虑的尺度越小,单位时间pH变化的斜率越陡,即pH变化越快越强。线性回归结果显示在右上角。数据来源如图2所示。
波动的可能影响有很多。显然,在波动的情况下,与环境变量(相对于目标物种的要求)的最佳值的距离不断变化。因此,在这种波动期间,物种的相对性能将增加或减少。生理反应可能会显示一些滞后,这反映了生物体的生理缓冲(例如内部pH控制)。当波动的变量周期性地超过生理阈值时,压力阶段可能与压力放松阶段交替出现。波动的制度可能会选择能够应对各种环境变量的“生理通才”。尽管许多生物体在对波动的环境变量的反应中表现出显着的表型可塑性(Hadfield和Strathmann 1996),但这种可塑性可能需要付出一些代价(Waldbusser和Salisbury 2014)。当环境参数变化快时,可塑性可能太慢,当波动具有高幅度和高频率时可能会发生这种情况。当生物体无法适应快速的瞬态变化时,它们的耐受范围应该很宽,否则它们可能会关闭敏感过程。当预期的波动包含在变暖处理中时,对变暖的反应更强烈,更消极(例如Vasseur等人,2014年)。一些这种增加的影响可能归因于Jensen不等式(图5)预测当响应曲线是曲线时,变量的对称波动通常会产生生物体的不对称响应。波动制度的另一个压力方面是极端事件更有可能发生。耐受阈值的瞬时越界,随后是松弛期,不仅可能有选择地有利于高表型可塑性(见上文),而且还可能选择更强大的基因型(Pansch等人,2014年)。
只有少数研究调查了pH(实际或未来)在相同平均pH(或pCO2)的恒定与波动pH方案中对生物体的影响是否不同。钙化大型藻类似乎在低pCO2水平和升高的pCO2水平下都会受到pH值波动的影响(Cornwall等人,2013年)。然而,厚边界层可能允许光合钙化剂在其叶状体表面创造有益的纳米栖息地,即使大量水被酸化到临界水平,也允许钙化(Cornwall等人,2014年)。这些作者表明,导致较薄边界层的强烈水湍流可能会削弱这种保护功能。低pH值脉冲(模拟上升流)会降低蜗牛的性能(Kim等人,2013年),但这种影响并未与具有相同平均pH值的恒定方案进行比较。波动的pCO2制度有利于珊瑚新兵的生长,可能是因为当pCO2高时,它们更容易隔离DIC(Dufault等人,2012年)。pH值波动可能会缓冲海洋酸化对珊瑚钙化的负面影响(Comeau等人,2014年)。当环境波动时,两种贻贝物种的幼虫受海洋酸化的影响较小(Frieder等人,2014年)。同样,Schneider、Sawall、Saderne、Hiebenthal、Müller和Wahl(未公开数据)发现pH值的生物波动减轻了海洋酸化对贻贝钙化的影响,因为贻贝将其钙化活动从酸化压力(即白天)。
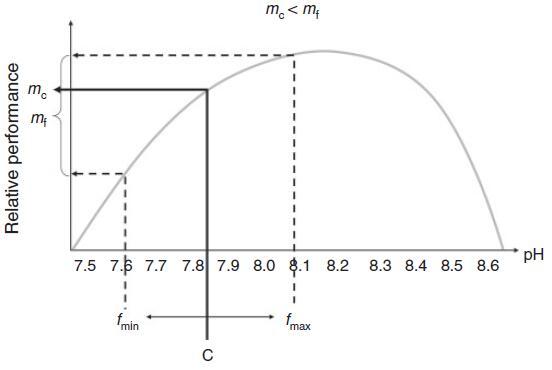
图5.Jensen不等式说明当环境变量和生物体性能之间的关系是非线性时,相同平均值的恒定(c)和波动(f)状态可能会产生不同的响应。因此,围绕驱动器平均值(c)的对称波动(在fmin和fmax之间)(本例中为pH值)可能会导致对恒定pH值的平均响应(mc)周围的不对称响应分布(mf),因此,降低目标物种的性能(mf,mc)。
已经描述了其他环境因素的一些波动效应。相对于相同平均值的恒定条件,脉冲低盐度对植物Halophila的压力更大(Griffin和Durako 2012),光脉冲减轻浮游植物的低光照压力(Helbling等人,2013),以及温暖的平均压力珊瑚周围的温度波动比恒温状态更严重(Putnam和Edmunds 2011),但恒温状态稍凉!)。在一项理论研究中,Vasseur及其同事(2014年)提出,相对于恒定的温度状况,波动有利于生活在较冷分布边缘的物种,但不利于生活在较暖分布边缘的物种,并且全球变暖的影响可能比想象的更剧烈一种将波动融入画面中。这些假设的经验证据仍然缺乏。
 相关新闻
相关新闻