热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
摘要
间歇性缺氧(IH)与阻塞性睡眠呼吸暂停(OSA)对心血管造成的后果有关。然而,由于缺乏合适的实验系统,无法评估间歇性缺氧对内皮是有害、保护还是两者兼有。这项工作的目的是确定IH氧合波动的频率和幅度对主动脉内皮伤口愈合的影响。使用一种新型可控系统对人原代内皮细胞单层进行损伤和恒定充氧(1%、4%、13%或20%O2)或不同频率(0.6、6或60次/小时)和幅度范围(13-4%O2或20-1%O2)的IH,24小时后测量伤口愈合情况。细胞单层修复在20%氧气和13%氧气条件下相似,但在4%氧气的持续低氧条件下显著增加(约两倍)。IH的幅度和频率在很大程度上调节了伤口愈合。在最低频率(0.6次/小时)下,13%-4%O2的循环可使内皮伤口愈合加快102%。然而,与13%-4%的氧气振荡相比,20%-1%氧气振荡的IH暴露会降低伤口闭合速度(在6个周期/小时和0.6个周期/小时时分别降低74%和44%)。模拟严重OSA的高频IH模式(60次/小时)并未显著改变内皮伤口的闭合,与氧合周期振幅无关。总之,间歇性缺氧IH中低氧循环的频率和幅度会明显改变伤口愈合反应,并成为决定细胞在OSA中如何反应的关键因素。
最新与值得关注
间歇性缺氧(IH)会对阻塞性睡眠呼吸暂停(OSA)患者的心血管造成影响。然而,以往在与OSA相关的实验研究中采用的各种频率和严重程度的IH导致了对IH影响结果的争议。通过采用优化的IH实验系统,我们提供的证据表明,间歇性缺氧IH的频率和程度明显改变了人体主动脉内皮的伤口愈合,成为决定细胞在OSA中如何反应的关键因素。
引言
阻塞性睡眠呼吸暂停(OSA)是一种非常普遍的呼吸系统疾病,可能会对神经认知、代谢、肿瘤和心血管造成不良后果。间歇性缺氧(IH)是由OSA患者上气道反复塌陷和重新开放引起的,是这种夜间呼吸障碍的主要有害挑战之一,与OSA的许多病症有关。然而,IH也被认为是通过诱导和促进细胞和器官的预处理而起到潜在保护作用的因素。事实上,关于IH对心血管的具体影响一直存在着激烈的争论。虽然IH会诱导释放活性氧和炎症介质,从而损害血管内皮功能,导致动脉粥样硬化,但IH也可能通过激活以诱发预处理为重点的适应性反应来发挥心脏保护作用和治疗作用。因此,关于持续气道正压疗法(或CPAP)对OSA患者心血管影响的先验结论相互矛盾,其原因可能在于IH的多态性,这一话题在过去几年中引起了广泛关注和争论。尽管人们一直认为周期性缺氧的程度和频率在IH对心血管系统的保护或损害作用中起着关键作用,但使天平倾向一方或另一方的IH特征的确切界限尚不清楚。
细胞培养是研究IH潜在影响的一种有价值的实验方法,因为与动物模型不同,细胞培养可以选择性地、精确地将细胞置于所选择的IH模式下。然而,由于缺乏合适的实验系统,无法在体外细胞中应用控制良好的IH模式,研究模仿OSA的IH如何调节细胞行为的工作一直受阻。最近,研究IH对细胞影响的方法学难题得到了解决,即在透气薄膜上培养细胞,允许氧气从膜下空间快速扩散到细胞。这种实验方法可以在振幅和频率方面对细胞应用精确控制的IH模式。鉴于我们有兴趣研究控制良好的模拟OSA的IH对细胞的影响,并且有合适的实验环境,本研究的目的是检验氧分压变化的频率和每个周期中达到的最大和最小氧值对细胞反应的特征起重要作用这一假设。更具体地说,我们使用一种模拟内皮修复的经典伤口闭合实验来评估这一假设,并研究轻度和重度OSA对应的两种实际IH频率(分别为6次和60次呼吸暂停/小时)对损伤后内皮细胞单层修复的影响。对于每种频率,我们还研究了两种氧分压高低范围的影响:20%-1%的氧气波动(这是基于IH的细胞研究中使用的原型)和13%-4%的氧气波动(这相当于OSA患者主动脉内皮细胞所经历的更真实的氧张力值)。事实上,在正常通气和气体交换条件下,如果没有发生呼吸暂停事件,动脉血中的氧分压(PaO2)约为100mmHg(即13%O2)。假设在严重OSA事件中动脉血氧饱和度(SaO2)可达到约60%的最低点,则相应的PaO2将为约30mmHg,相当于4%的氧气。
方法
细胞培养。从美国类型培养物保藏中心(ATCC)获得的人原代主动脉内皮细胞(HAEC)常规生长在血管细胞基础培养基中,该培养基补充了内皮细胞生长试剂盒-VEGF(ATCC)和抗生素/抗真菌溶液,抗生素/抗真菌溶液的最终浓度为10U/ml青霉素、10g/ml链霉素和25g/ml两性霉素B。实验前,将细胞培养物保存在T-25组织培养瓶中,置于20%O2,5%CO2和37℃的标准加湿培养箱中。在使用下述体外系统进行实验时,使用的是混合度为75%的第4和第5代培养物。
IH体外应用的实验环境。在体外细胞暴露于恒定或可变氧气浓度(IH)的实验中,采用了一种定制的实验装置,该装置由一个聚二甲基硅氧烷(PDMS)系统组成,该系统是根据之前的设计改良而成的。设计的装置以直径20毫米的PDMS孔为基础,孔内有90μm厚的透气PDMS膜(图1A)。孔的底部与气源相连,通过薄膜的直接扩散,使恒定的混合气体或循环变化的气体成分循环到膜顶部培养的细胞中。PDMS孔是用Autodesk 123D设计软件设计的阴性聚乳酸模具制成的,并用Ultimaker-2 3D打印机打印出来。简而言之,将PDMS混合物倒入阴模中,然后用真空罐去除气泡,再将混合物放入65℃的烤箱中烘烤3小时,使PDMS固化,然后从模具上剥离PDMS,得到复制品。另一方面,PDMS膜是按照之前描述的方案在硅晶片上制作的。为了获得90μm厚的膜,将PDMS混合物倒在晶片中心,以1,000rpm的转速旋转1分钟。
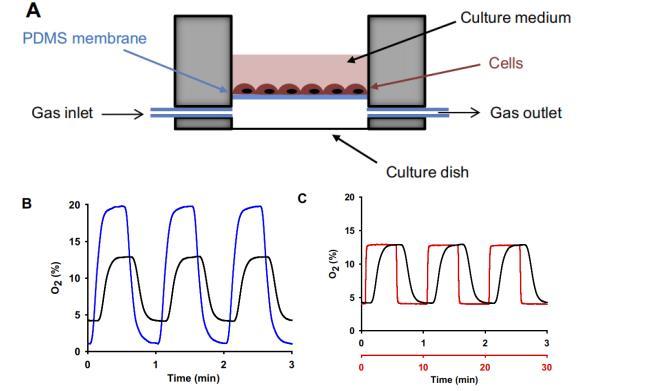
图1细胞暴露于恒定或可变氧气浓度的体外实验系统。A:对培养细胞进行受控间歇性缺氧(IH)的细胞培养设置示意图(解释见正文)。B:以60次/小时的频率进行不同量级的IH(20-1%O2(蓝线)和13-4%O2(黑线))时,在膜顶部(细胞培养层)测得的实际氧气浓度。C:以60次/小时(黑线)和6次/小时(红线)的频率施加13-4%O2的IH时,在膜顶部(细胞培养层)测得的实际氧气浓度。每个时间轴的颜色与相应的线相关联。B和C中的信号在时间上有所偏移,以便于视觉比较。
为了确认气体刺激在频率和振幅方面从气体搅拌器正确传递到培养细胞,所有用于体外实验的培养系统都在使用前进行了校准。使用氧气微传感器(Unisense)测量膜顶部(细胞培养层)的氧气浓度显示,系统平衡时间约为7秒,从而验证了应用不同IH模式(包括模拟OSA的高频模式)时实验设置的正确显示(图1,B和C)。如图所示,改变氧气失饱和的频率会改变失饱和和再饱和的持续时间。虽然这种IH模型并不能完全模拟OSA患者在不同呼吸暂停指数下的实际缺氧/复氧时间,但它再现了大多数IH实验中的循环模式。
 相关新闻
相关新闻