热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
背景介绍:H2S是一种内源性气体信号分子,参与调节血管张力。它在低浓度下具有生物活性,而在高浓度下则有毒性。内源性硫化氢(H2S)参与了血管张力的调节。假设钙离子降低和钾(K)通道开放以及钙离子依赖性机制参与了H2S诱导的大鼠肠系膜小动脉松弛。安培计记录显示,在封闭的试管中加入硫氢化钠(NaHS)、Na2S和GYY4137[P-(4-甲氧基苯基)-P-4-吗啉基二硫代磷酸]后,游离[H2S]分别为加入量的14%、17%和1%。这两种化合物在等长肌电图中引起的松弛程度相当,但根据测量的游离[H2S],与NaHS和Na2S相比,GYY4137在大鼠肠系膜小动脉中引起的松弛程度与释放的游离H2S有关。同时测量[H2S]和张力表明,15μM的游离H2S在肠系膜上动脉中可引起61%的松弛。对平滑肌钙和张力的同步测量显示,NaHS降低了钙,并导致NE收缩的动脉松弛,而高细胞外钾降低了NaHS的松弛,但没有相应的钙变化。在NE收缩的动脉中,NaHS(1mM)降低了肌球蛋白轻链的磷酸化,而肌球蛋白磷酸酶靶亚基1的磷酸化保持不变。蛋白激酶A和G、鸟苷酸环化酶抑制剂未能降低NaHS的松弛作用,而电压门控KV7通道阻断剂抑制了NaHS的松弛作用,线粒体复合物I和III阻断剂取消了NaHS的松弛作用。研究结果表明,低微摩尔浓度的游离H2S可打开K通道,继而降低平滑肌钙离子,并通过涉及线粒体复合物I和III的另一种机制导致力的解偶联,从而实现血管扩张。
Unisense硫化氢微电极的应用
应用Unisense微电极技术测试体系中的硫化氢含量,其测试原理是体系中的硫化氢通过外部压力进入到电极尖端中传感器顶端膜后进入到碱性电解质液中并转化为相应的电信号。硫化氢电极对于温度较为敏感,本实验中的硫化氢是在37度(生理环境温度)下、PH小于4的体系环境中进行校正的。硫化氢的测试是在含有PSS(PH=7.4)的闭管中进行测试。在研究H₂S对肠系膜小动脉松弛作用时,H2S微电极被用于同时测量H₂S浓度和血管张力的变化。通过将微电极插入动脉腔内,同时记录血管的收缩和松弛情况,能够直接观察到H₂S浓度与血管松弛之间的动态关系。
实验结果
低微摩尔浓度的游离H2S能够引起大鼠肠系膜小动脉的松弛。研究通过同时测量H2S浓度和血管张力,发现15µM的H2S在肠系膜上动脉中可引起61%的松弛,表明H2S在调节血管张力中具有重要作用。GYY4137作为一种缓释型H2S供体,虽然在生理pH下几乎不释放可检测的游离H2S,但其引起的血管松弛效果与NaHS和Na2S相当,提示GYY4137可能通过其他机制(如释放其他硫化物或非硫化物依赖机制)发挥作用。H2S诱导的血管松弛涉及钾离子通道的开放。研究发现,KV7通道阻断剂(如XE991和linopirdine)显著抑制了NaHS引起的血管松弛,表明KV7通道在H2S诱导的血管松弛中起重要作用。其他钾离子通道(如KATP通道和BKCa通道)的阻断剂(如glibenclamide和iberiotoxin)对NaHS引起的松弛无显著影响,提示这些通道可能不参与H2S诱导的血管松弛。NaHS在低浓度时可增加平滑肌细胞内钙离子水平,而在高浓度时则降低钙离子水平并引起血管松弛。这表明H2S诱导的血管松弛部分依赖于钙离子水平的降低。在高钾条件下,NaHS引起的松弛减弱且不伴随钙离子水平变化,进一步证实了钾离子通道在H2S诱导的血管松弛中的作用。线粒体复合体I和III的抑制剂(如鱼藤酮和抗霉素A)显著抑制了NaHS引起的血管松弛,表明H2S可能通过直接抑制线粒体电子传递链来抑制力的产生,从而引起血管松弛。
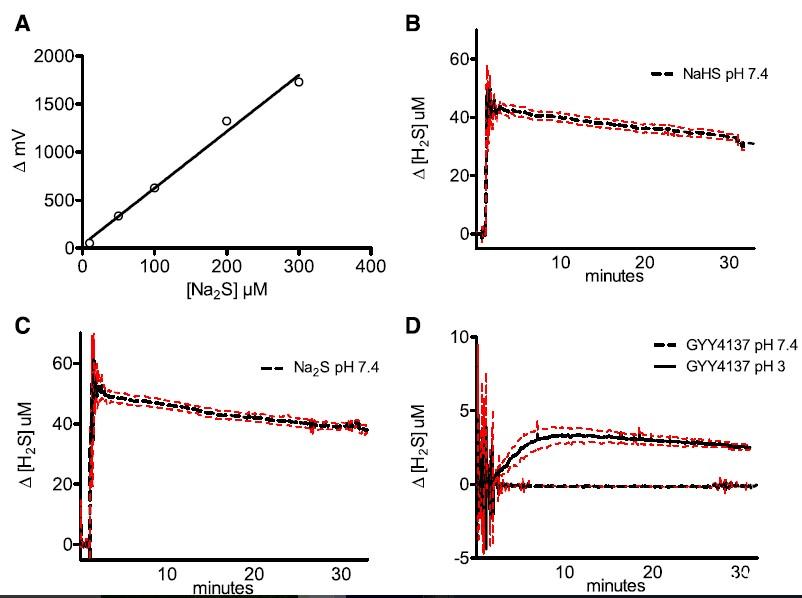
图1、(A)在含有PSS(生理盐水溶液)体系中加入硫化钠进行校正得到的校正曲线;(B)体系中加入300μmNaHS所引起H2S含量的变化情况。(C)体系中加入300μmNa2S后所引起H2S含量的变化情况。(D体系中加入300μmGYY4137后所引起H2S含量的变化情况。
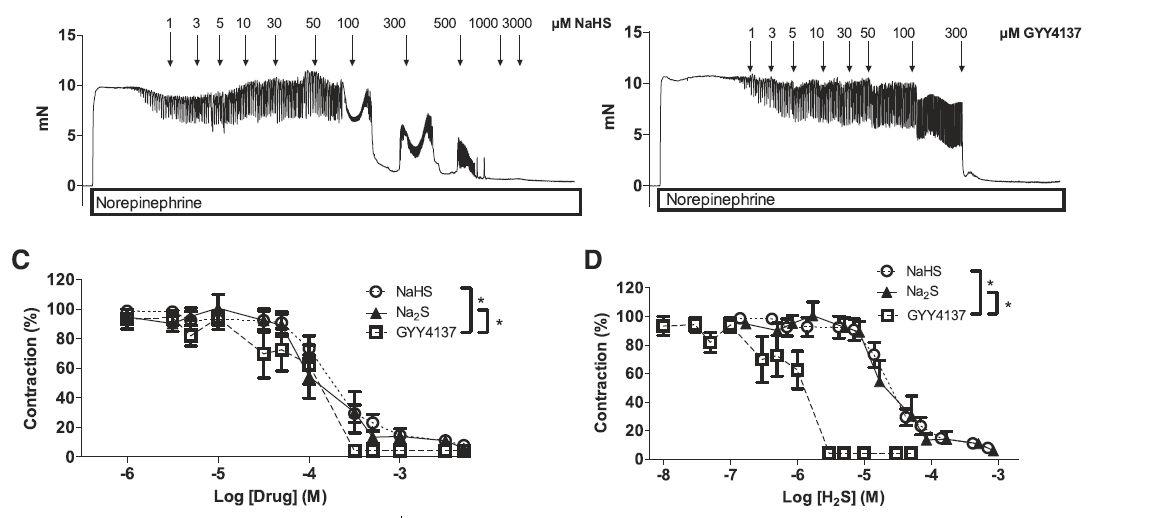
图2、硫化氢给体引起的老鼠肠系膜动脉的松弛。(A)在去甲肾上腺素存在下使用肌动描记器记录所添加不同硫化氢钠的量引起老鼠肠系膜动脉的弹性张力变化情况的全要素原图。(B)在去甲肾上腺素存在下使用肌动描记器记录所添加不同GYY4137的量引起老鼠肠系膜动脉的弹性张力变化情况的全要素原图.(C)在去甲肾上腺素存在下,NaHS、Na2S、GYY4137三种硫化盐的浓度对于老鼠肠系膜动脉的收缩程度的影响。(D)基于三种硫化氢给体测试出的硫化氢的浓度对于老鼠肠系膜动脉的收缩程度的影响。
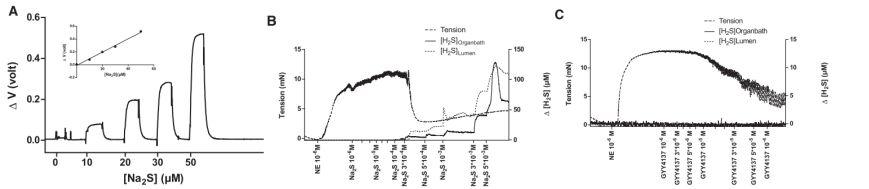
图3、老鼠肠系膜动脉系统的H2S和松弛度的同测试。图A指的是在在PH为4.0的体系中将硫化钠添加到PSS体系的校正曲线图,插图是校正的线性回归图。图B指的是使用1um的去甲肾上腺后,体系中添加硫氢化钠后,在器官浴中和在管状内腔中测试老肠系膜上动脉的张力变化和硫化氢浓度的变化情况。图C指的是使用1um的去甲肾上腺后,体系中添加YY4137后,在器官浴中和在管状内腔中测试老肠系膜上动脉的张力变化和硫化氢浓度的变化情况。

图4、细胞内钙水平和张力同时对外源H2S的反应。(A)NaHS诱导的大鼠肠系膜小动脉在NE(3μM)收缩下的收缩和钙比率变化的原始轨迹。(B)NE(3μM)收缩下肠系膜动脉的收缩和钙比率(C)60mM K(K60PSS)收缩下肠系膜动脉的收缩和钙比率。结果为5至6只动物动脉节段的平均值±S.E.M.。*P<0.05分别与收缩或钙水平的初始水平相比。
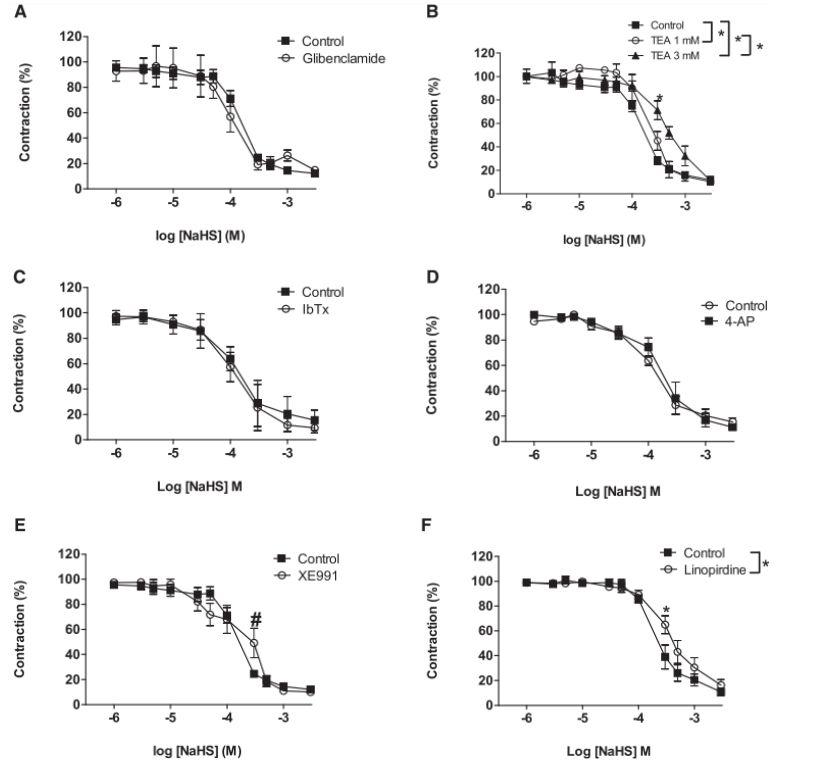
图5、在NE(3mM)收缩的肠系膜动脉中,K通道阻滞剂对NaHS累积浓度反应的影响(A)格列本脲(10mM)的影响(n=6-28)。(B)三乙醇胺(1mM和3mM)的影响(n=7-28)。(C)iberiotoxin(100nM)的影响(n=7-9)。(D)4-氨基吡啶(0.5mM)的影响(n=6-7)。(E)XE991(10mM)的影响#P,0.05,经t检验(n=9-28)。(F)linopirdine(10mM)的影响(n=9-28)。
结论与展望
探究了硫化氢(H2S)诱导大鼠肠系膜小动脉舒张的机制,发现低浓度H 2S通过钾通道和线粒体相关机制发挥作用,为深入理解H2S对血管张力的调节提供了依据。研究硫化氢(H2S)对老鼠肠系膜小动脉松弛作用的机制,特别是钾离子通道和钙离子独立机制在其中的作用。研究表明H2S可以通过多种机制影响血管张力,包括降低细胞内钙离子浓度、激活钾离子通道等,但其具体作用机制尚未完全明确。低微摩尔浓度的H2S通过打开钾离子通道、降低平滑肌细胞内钙离子水平以及通过线粒体复合体I和III的独立机制来引起血管松弛。这些发现为理解H2S在血管生理和病理中的作用提供了新的视角,并可能为开发基于H2S的治疗策略提供理论。unisense微电极系统通过精确测量H2S浓度,为研究H2S在血管生理中的作用机制提供了关键数据。其高灵敏度和实时监测能力使其成为研究H2S生物学效应的重要工具。GYY4137诱导游离H2S释放可能依赖组织硫醇或释放其他硫化物,需探究其具体机制,以及是否存在不依赖硫化物的机制参与其舒张作用。研究发现H2S对KV7通道和线粒体途径有影响,后续可深入研究这两个途径在低浓度H2S发挥心脏保护作用中的具体机制和相互关系,为心血管疾病治疗提供更深入的理论依据。