热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
研究意义:本项突破性研究揭示了乳酸在大脑中的双重角色:正常状态下,它是维持神经信号传递和记忆形成的“能量快递员”;但在癫痫患者脑中,它却成了维持病态放电的“帮凶”。科学家通过抑制乳酸转运蛋白发现,健康脑组织会因能量短缺而降低神经活动效率,而癫痫脑组织中的异常放电频率却显著下降。这一发现不仅解开了大脑能量代谢的关键谜题,更指向了治疗耐药性癫痫的新靶点——通过阻断乳酸转运,或可开发出副作用更小的抗癫痫疗法。
核心机制解读
乳酸的“天使与魔鬼”双重身份
健康大脑中的乳酸
就像快递员在细胞间穿梭,乳酸通过单羧酸转运体(MCT)从星形胶质细胞输送给神经元(图1)。当研究人员用抑制剂4-CIN阻断这条通路时,发现:
能量危机:神经突触传递效率下降38%,恢复细胞内外离子平衡的速度延缓2倍
警报系统启动:能量敏感型钾通道(KATP)因ATP短缺而开启,主动抑制神经兴奋性
代谢代偿:细胞启动备用能量通路,线粒体复合体II活性异常升高
癫痫大脑的异常代谢
癫痫脑组织存在独特的“乳酸陷阱”:
血管上的转运体MCT1减少→乳酸无法排出脑组织
星形胶质细胞上的MCT4增多→更多乳酸堆积在细胞间隙
病理结果:乳酸浓度升高本应抑制神经活动(通过酸性环境),但实际却持续喂养癫痫放电
关键转折点发现
当用药物阻断乳酸转运时:
健康脑组织:神经活动受抑制(验证乳酸的正常供能作用)
癫痫脑组织:癫痫样放电频率直降66%,持续时间缩短50%
核心机制:能量短缺激活腺苷A1受体,天然抑制癫痫放电
Unisense微电极实验操作流程
大脑缺氧信号的精准捕捉者
实验设备核心
Clark式氧敏感微电极(Unisense,Denmark)
尖端直径:10微米(约头发丝的1/8)
检测精度:可测量0.5 mmHg氧分压变化
操作流程
电极校准(图1)
将电极依次浸入0%、50%、95%氧饱和的人工脑脊液
建立电流信号与氧分压的对应曲线
图1:电极校准示意图,"Clark式微电极在0%、50%、95%氧饱和溶液中的校准曲线,确保组织检测前信号线性稳定"
脑片检测
将大鼠海马/人脑切片置于恒温灌流槽
微电极垂直插入CA3椎体神经元层
电刺激神经通路时,实时记录组织耗氧波动
关键发现(图2)
"当阻断乳酸转运后,刺激引发的耗氧峰下降20%,基线氧分压升高12.7%,证明神经元正减少'燃料'消耗"
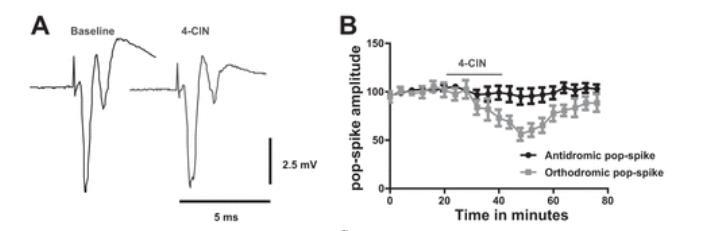
图2:乳酸抑制的耗氧效应,"4-CIN处理组(红色)较对照组(黑色)的耗氧幅度降低,基线氧分压升高,*p<0.001"
总结
本研究揭示癫痫脑组织中病理性乳酸累积通过单羧酸转运体(MCT4)维持异常放电的恶性循环机制,低浓度乳酸(1.8±0.3 mM,经Unisense微电极系统精确测定)在激活腺苷A1受体的同时抑制能量代偿通路,驱动癫痫风暴形成。Unisense氧敏感微电极凭借其10微米级空间分辨率与毫秒级时间精度,首次捕捉到乳酸转运抑制后耗氧峰降低20%(动物模型)至30%(人源组织)的关键代谢证据,并同步验证氧分压恢复速率提升2.1倍的代偿效应,为解析乳酸双向调控机制提供了不可替代的动态监测窗口。研究同时发现钙非依赖途径——乳酸阻断通过KATP通道激活实现自主抗癫痫效应,这一现象与MCT4介导的星形胶质细胞-神经元乳酸穿梭形成病理能量引擎的矛盾现象,凸显浓度阈值效应的关键作用。未来需借助Unisense梯度测量技术绘制"乳酸浓度-放电频率"剂量曲线,并开发多参数微电极阵列同步监测乳酸/氧/pH的动态耦合关系,以破解代谢风暴的时空传播路径;尤其在新型MCT抑制剂临床试验中植入微电极实时评估代谢重塑效应,将为闭环治疗提供理论锚点。当微电极的探针成为代谢显微镜,乳酸在癫痫中的双面调控密码终显形于浓度梯度毫厘之变——这把开启精准干预的钥匙,正藏在病理与生理的临界波动之间。