热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
3结果
3.1肉汤中氧饱和度对洛伐他汀生物合成的影响
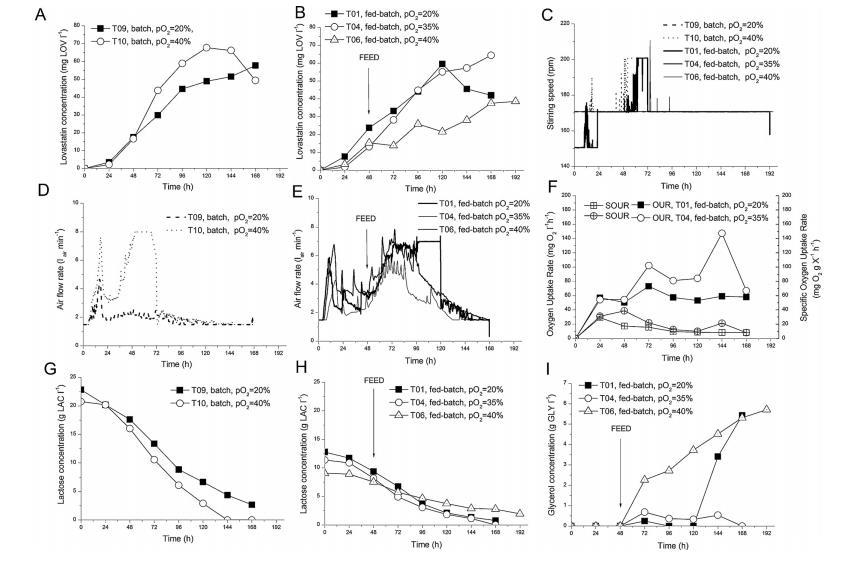
图1、分批和连续分批补料实验中培养基成分和工艺参数的时间变化,以显示氧饱和度对洛伐他汀生物合成的影响:(A)分批运行中的洛伐他汀浓度,(B)连续分批补料运行中的洛伐他汀浓度,(C)搅拌速度,(D)间歇运行中的空气流速,(E)连续分批补料运行中的空气流速、(F)连续分批补料运行中的氧气吸收率(OUR)和比氧气吸收率(SOUR);(G)分批运行中的乳糖浓度;(H)连续分批补料运行中的乳糖浓度;(I)T01、T04、T06、T09和T10试验中获得的连续分批补料运行中的甘油浓度。
氧气是影响土霉菌中洛伐他汀形成的最重要因素之一。它有几个作用。首先,洛伐他汀的形成需要分解代谢途径中碳源的高强度氧化,以形成丙二酰CoA,丙二酰CoA是洛伐他汀非酮类合成酶(LNKS)延伸聚酮链的单位。其次,洛伐他汀形成过程中所谓的后PKS阶段需要氧气,即在氧合酶催化下,由LNKS合成的中间体4a,5-二氢洛奈可林进行修饰。第三,真菌进行有氧生长,通过氧化途径消耗碳底物以产生能量。
在第一组实验中,研究了氧饱和度(pO2)对生物反应器中洛伐他汀生物合成的影响。图1A和B显示了在不同的pO2水平下,分批和连续分批补料生产时生产介质中洛伐他汀浓度的变化。土霉菌生产的洛伐他汀受pO2的影响,在分批补料工艺(运行T04)中,当pO2设为35%时,168小时的滴度为65mg LOV/l。在分批运行T10中,当氧饱和度为40%时,洛伐他汀的滴度在120小时时达到69mg LOV/l,但随后由于乳糖的缺乏,形成的产物被重新利用(图1F),在168小时时仅发现49毫克LOV/l。比较T09(pO2=20%)和T10(pO2=40%)两个分批实验,可以明显看出,在72至120小时的运行期间,较高的氧饱和度有利于洛伐他汀的形成。另一方面,在pO2设为40%的甘油连续分批补料实验(T06)中,洛伐他汀的滴度(约30毫克LOV/l)明显低于pO2=40%的分批实验,最终约6克GLY/l仍未在培养基中使用(图1B和I)。
在这一组分批进行的实验中,T04的结果最好(69mg LOV/l),其中pO2控制在35%,尽管肉汤中的洛伐他汀浓度直到96小时都低于T01(pO2=20%)。由于在所有实验中肉汤中的氧饱和度都被控制在一个设定的水平,因此空气流速(和搅拌速度,如果观察到的话)的变化反映了土霉菌对氧气的需求。图1D和E显示了选定运行的空气流速。在分批补料运行(T01、T04和T06)中,补料开始时碳底物(甘油)供应的增加导致空气流速增加。
值得注意的是,与运行T09相比,分批运行T10对氧气的需求要高得多,在该运行中,洛伐他汀的生产率很高,氧饱和度被控制在40%的最高水平(图1D)。在所有运行的早期滋养阶段(12小时左右)以及分批补料运行T01和T06中(pO2控制在40%),氧气吸收率非常高,以至于达到了空气流速的上限,因此搅拌速度增加了(图1C)。
在两次分批补料实验(T01和T04)中,氧气需求量也用氧气吸收率(OUR)和特定氧气吸收率(SOUR)表示。这些速率随时间的变化如图1F所示。在设定了较高氧饱和度(35%)的实验(T04)中,OUR和SOUR值均高于实验T01。具体来说,晚期特异相中较高的OUR值与这一阶段较高的洛伐他汀滴度相关(比较图1B和F)。
在实验T04、T06和T10中,为维持设定的pO2值而必须增加空气流速和搅拌速度,这导致土霉菌从颗粒形态变为分散形态,这种变化影响了生物反应器中肉汤的流变特性。当出现分散形态时,生物反应器壁上的停滞区清晰可见,这表明在这些运行过程中肉汤具有剪切变稀的行为。这些停滞区在T04试验中尤为明显,在该试验中,由于较高的剪切力(pO2设置为35%),在工艺开始时形成的蓬松(松散)颗粒后来转变为分散形态。而在运行T01(pO2设为20%)时,流变学没有发生这种变化:在工艺开始时形成的密度更大(更紧密)的颗粒在实验后期没有被破坏。在T01和T04试验中,氧气的对流传质系数(kLa)值与土曲霉的形态(颗粒状或分散状)相吻合。在T01运行中,当颗粒占主导地位时,kLa在0.016到0.024s-1之间变化,而在T04运行中,当分散形态占主导地位时,kLa在72到120小时之间在0.0036到0.0085s-1之间变化。
最后,碳底物浓度随时间的变化取决于pO2的控制水平(图1G-I)。在氧气较多(pO2=40%)的批次运行T10中,乳糖较早被完全耗尽,而在运行T09(pO2=20%)中,乳糖一直留在肉汤中,直到实验结束(图1G)。在分批补料实验T01和T04中,无论设定的氧饱和度如何,乳糖的利用率都差不多,尤其是在开始补料之前(图1H)。在分批进行的T06试验(pO2=40%)中,乳糖的利用速度较慢,这可能是因为真菌形态发生了不利的变化,即由于机械应力导致颗粒和菌丝破坏。与此同时,甘油的利用速度也很慢,从开始补料起就一直在积累。这些因素综合在一起,导致本实验的洛伐他汀产量相对较低。而其他两次分批进行的补料实验则不同。在T04试验中,所有添加的甘油几乎全部被消耗,而在T01试验中,甘油的浓度在试验后期有所增加,达到约5.5g GLY/l。
总之,在分批生产过程中,较高的pO2值会加快碳底物(乳糖)的利用率,而众所周知,这有利于洛伐他汀的形成。在分批式工艺中,40%的pO2水平是最佳的,但在补料式工艺中则不是。由于有更多的可用碳底物,在所有设定的pO2水平下,特别是在pO2=40%时(实验T06),分批补料运行的洛伐他汀滴度应该会好得多。然而,这里的情况并非如此。在所有这些实验中,除了真菌形态外,生物反应器中的所有工艺条件都是完全可控的。由于生物反应器中剪切应力的增加,真菌形态发生了不良变化,从最初的颗粒状变成了分散的菌丝碎片。这些变化主要发生在pO2设置为35%或40%的运行过程中。从理论上讲,在这些实验中,菌丝体获得更多的氧气应该会提高洛伐他汀的滴度,但这并不像人们所期望的那样明确。因此,我们进行了一项实验,研究洛伐他汀滴度与颗粒内氧气水平的关系。
3.2颗粒大小和结构对连续补料工艺中颗粒中氧气分布的影响
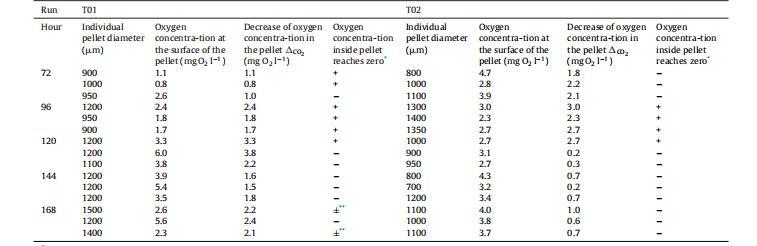
表1、实验T01和T02(不同的培养前准备)的颗粒内氧气浓度测量(每小时使用三个颗粒)。
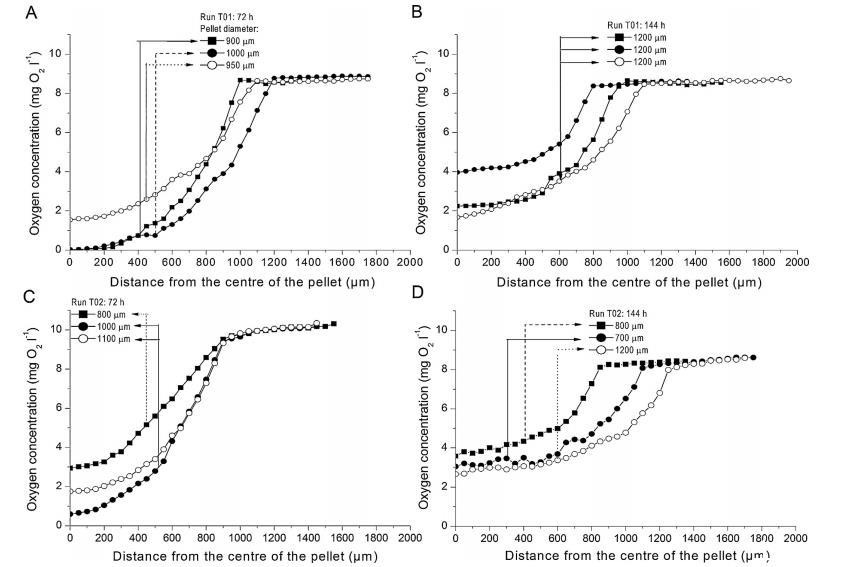
图2、生产培养基颗粒中的颗粒内氧浓度曲线:(A)T01运行72小时后;(B)T01运行144小时后;(C)T02运行72小时后和(D)T02运行144小时后;带箭头的垂直线代表颗粒表面;这样,边界层中的氧浓度梯度与颗粒内的梯度就区分开了。
在T01(见第3.1节)和T02两项连续分批进行的实验中,pO2控制在20%,以避免空气流速和搅拌速度的大幅增加,从而将剪切应力降至最低。这样可以在生物反应器中尽可能长时间地保持菌丝的颗粒结构,并测量颗粒内的氧气浓度分布。此外,由于在预培养准备过程中采用了不同的方法从斜面上清洗孢子(见第2.1节),在这两次实验中获得的颗粒大小略有不同,但结构却大相径庭。T02试验中形成的颗粒稍小,结构松散、蓬松。还能观察到一些分散的菌丝。而T01试验形成的颗粒则更为紧凑。在这两次实验中,颗粒形态一直保持到168小时,而第3.1节中描述的其他实验则没有这种情况。因此,可以在静态条件下测定颗粒内的氧气浓度曲线(见第2.2节)。需要注意的是,这些测量过程中的传质条件并不能准确反映生物反应器中的传质条件。因此,根据颗粒表面的氧气浓度和颗粒内部(即表面和中心之间)氧气浓度的下降情况,对从T01和T02实验中取出的颗粒进行了简化比较。表1显示了所有这些结果。
对于在T02试验中获得的结构松散的稍小颗粒,只有少数颗粒内部的氧浓度降为零。而在T01试验中获得的结构更紧凑的较大颗粒中,在不同培养时间测试的15个颗粒中有8个的氧气浓度为零。此外,在T01试验的颗粒中,从颗粒表面到中心的氧气浓度(CO2)下降幅度(平均为1.9毫克O2/l)高于T02试验的颗粒(平均为1.3毫克O2/l)。
图2显示了颗粒内氧气浓度分布的示例。在运行T02的结构密度较低的颗粒中,氧气深入颗粒内部。这种情况在72小时内尤为明显,这对高效生产洛伐他汀至关重要。72小时时,通常是洛伐他汀生产率和乳糖利用率最高的时候,只有在T01运行的颗粒中,也就是在形态致密的颗粒中,氧气浓度才降到零(图2A和C)。当乳糖成为限制条件时,两次运行的颗粒中的氧浓度再次上升(图2B、D和图3B),表明氧消耗速度减慢。在T02试验中,氧浓度的增加高于T01试验,这与肉汤中检测到的乳糖含量较低有关(图3B)。
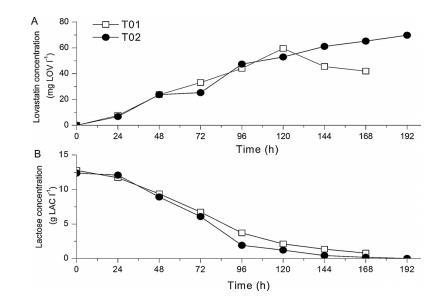
图3、在不同的培养前准备和接种(T01和T02)实验中,(A)洛伐他汀和(B)乳糖浓度的时间变化。
3.1显示,通过提高肉汤中氧饱和度的设定水平,提高了洛伐他汀的生物合成。本节的结果表明,确保颗粒内的高氧浓度也有利于提高洛伐他汀的滴度(图3A):168小时后,氧饱和度较高、颗粒较松散的T02试验的洛伐他汀滴度比颗粒较紧凑的T01试验高出25毫克LOV/l。
尽管稍小和较松散的颗粒对洛伐他汀滴度的增加作用不大,但我们的研究结果表明,控制真菌形态有利于土霉菌生产洛伐他汀。因此,我们采用了微颗粒强化培养技术(MPEC)。
 相关新闻
相关新闻