热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870

图3、展示iCarP照明对大鼠心脏的不同模式。a、b iCarP支持照明的颜色变化,同一设备发出的光为(i)405 nm,(ii)520 nm,(iii)660 nm。c、d脉冲照明1 Hz,(i)、(ii)、(iii)显示开关的开启和关闭。e、f iCarP随着时间的推移逐渐增加照明强度。白色箭头表示光纤。
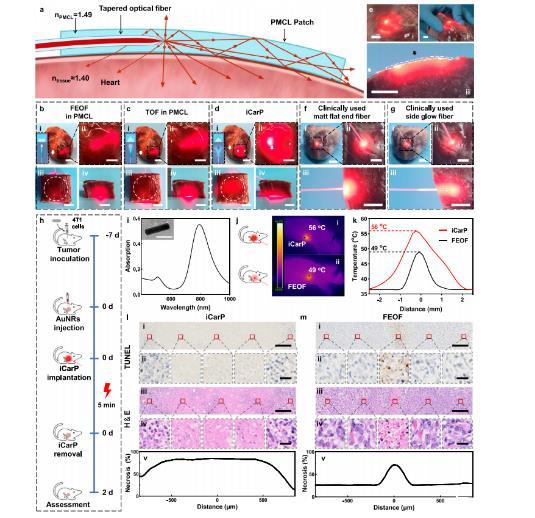
图4、不同光纤/贴片光子器件的照明范围和深度以及肿瘤光热消融效果的比较。a iCarP光学路径的横截面示意图。b–d被光子器件照明的离体猪心的全景图(i)和放大图像(ii):平面光纤(FEOF)在PMCL中(b),TOF在PMCL中(c),以及iCarP(d),插图:光纤端结构和相应的光散射图示,(i)比例尺=2.5厘米;(ii)比例尺=1厘米。白色箭头表示光纤。顶视图(iii)和正视图(iv)的1.5厘米厚心脏组织,被相应的光子器件照亮(器件完全被心脏组织覆盖;它们的位置用白色圆圈标出),比例尺=1厘米。e iCarP照明对离体猪心的影响,比例尺=1厘米。白色箭头表示光纤,黑色箭头表示空气间隙的位置。(i)iCarP以较低功率照明的猪心,与(d)中的情况相比,显示了散射光的分布。(ii)iCarP照明扭曲的猪心。(iii)iCarP和猪心肌的横截面,与(a)中的配置相同。f、g临床上使用的哑光平端光纤(f)和侧发光光纤(g)的照明范围和深度。离体猪心的全景图(i)、放大图像(ii)和横截面(iii)。比例尺=1厘米。h动物研究的时间线。i金纳米棒的光吸收谱,插图:>100金纳米棒的代表性透射电镜图像。比例尺=50微米。j iCarP(i)和FEOF(ii)照明的小鼠的红外热成像。k iCarP(i)和FEOF(ii)照明的小鼠的温度。l、m iCarP(l)和FEOF(m)照明的治疗效果(代表性的n=3个生物独立样本)。(i)照明肿瘤的代表性TUNEL染色图像,比例尺=200微米。(ii)TUNEL染色图像,比例尺=20微米。(iii)照明肿瘤的代表性H&E染色图像,比例尺=200微米。(iv)放大的H&E染色图像,比例尺=20微米。(v)基于H&E染色的坏死的定量分析。
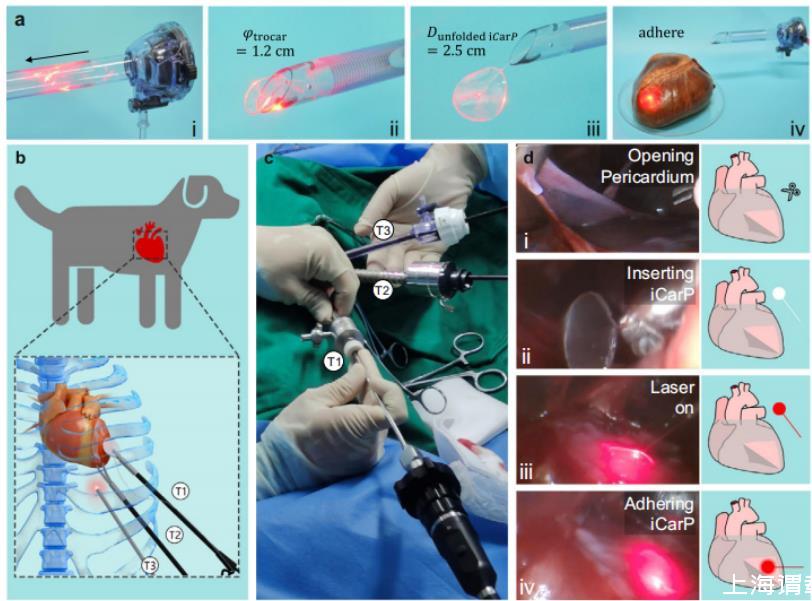
图5、iCarP与微创植入兼容。a iCarP在经过切口器的穿透:(i)折叠的iCarP(直径2.5厘米)插入切口器(直径1.2厘米),(ii)iCarP通过切口器的出口,(iii)iCarP通过切口器穿过并展开,(iv)展开的iCarP粘附在猪心表面。b在犬模型中进行微创植入iCarP的示意图。T1:用于抓取镊子的切口器;T2:用于弯曲剪刀的切口器;T3:用于内窥镜的切口器。c在犬模型中进行微创植入iCarP的胸腔镜下植入。d iCarP植入的步骤示意图:(i)开放心包;(ii)插入iCarP;(iii)打开照明;(iv)粘附iCarP。
结论与展望
在光谱、面积、深度和强度方面具有高度可控性和适应性的内脏和组织的诊断和治疗照明仍然是一个重大挑战。研究人员提出了一种称为iCarP的柔性、可生物降解的光子器件,该器件在折射聚酯贴片和嵌入的可移除锥形光纤之间具有微米级的气隙。ICarP结合了锥形光纤的光衍射、气隙中的双重折射和贴片内部的反射等优点,获得了灯泡状照明,将光引导向目标组织。
研究表明iCarP在不刺穿目标组织的情况下实现了大面积、高强度、宽光谱、连续或脉动、深度穿透照明,并证明它支持不同光敏剂的光疗。研究发现光子设备与基于胸腔镜的微创植入到跳动的心脏上是兼容的。这些初步结果表明,iCarP可能是一种安全、精确和广泛应用的设备,适用于内脏和组织照明以及相关的诊断和治疗。本研究不仅在技术上取得了创新,还为未来体内光疗的临床应用提供了新的可能性。iCarP的设计和应用展示了其在提高光疗效果、减少组织损伤和提高患者安全性方面的潜力。
随着进一步的研究和开发,这种光子贴片可能会在心血管疾病、肿瘤治疗以及其他需要光疗干预的领域发挥重要作用。Unisense微电极在本研究中发挥了关键作用,通过监测藻类的光合作用产生的氧气,验证了iCarP光子贴片的光照效果和生物医学应用潜力。氧气微电极通过监测光照过程中藻类悬浮液中溶解氧浓度的变化,帮助研究人员评估iCarP产生的光照是否能够有效促进藻类的光合作用。这对于评估iCarP在生物医学中的应用前景非常重要,因为它需要确保光照能够有效地激活生物过程。这表明iCarP能够有效地将光能量传递到目标区域,并且光照强度和分布足以支持光合作用的进行。这些数据支持了iCarP作为一种光子设备在生物医学应用中的有效性,特别是在需要光合作用来产生氧气的治疗场景中,例如心肌梗死治疗。
 相关新闻
相关新闻