热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
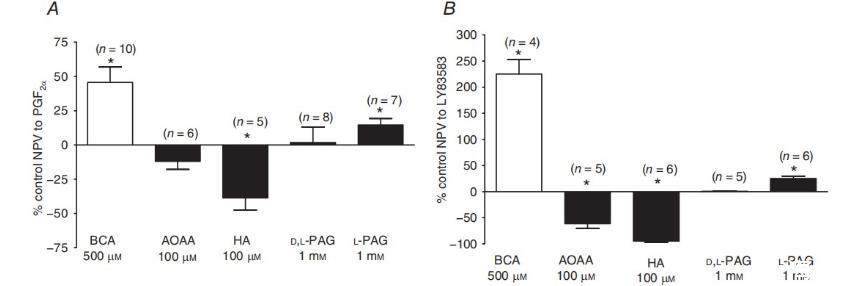
图1、硫化物合成阻断剂对PGF2α和LY83583反应的影响。A)几种CSE拮抗剂(BCA,500μM;AOAA,100μM;HA,100μM;D,L-PAG,1mM;L-PAG,1mM)对30μM PGF2α诱发的收缩的影响。B)几种PAG阻滞剂对10μM LY83583诱导的收缩的影响。
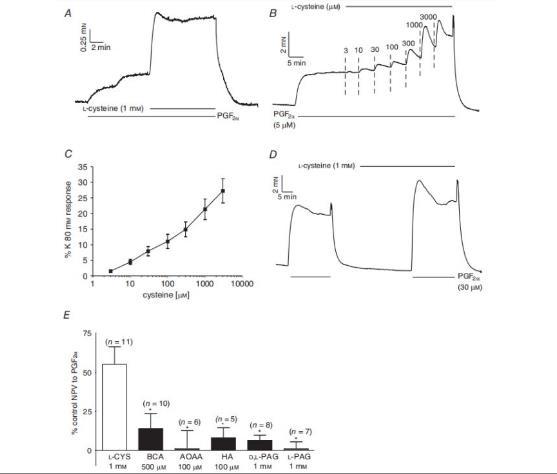
图2、L-半胱氨酸对IPAs基础张力和PGF2α诱导的张力的影响。A,显示5μM PGF2α诱导NPV期间1mM L-半胱氨酸引起张力增加的示例轨迹。B,在5μM PGF2α诱导的NPV期间,半胱氨酸(3μM-3mM)引起的张力增加的浓度依赖性示例。C,使用B所述方案记录的张力平均增加值,显示为对80mM K+PSS反应的百分比,代表该动脉环的最大收缩量(n=15)。D,1mM半胱氨酸预处理对30μM PGF2α诱导的收缩的影响示例。E,在无CSE抑制剂(最左侧条)和有CSE抑制剂的情况下,1mM L-半胱氨酸对30μM PGF2α诱导的收缩的平均±SEM影响。
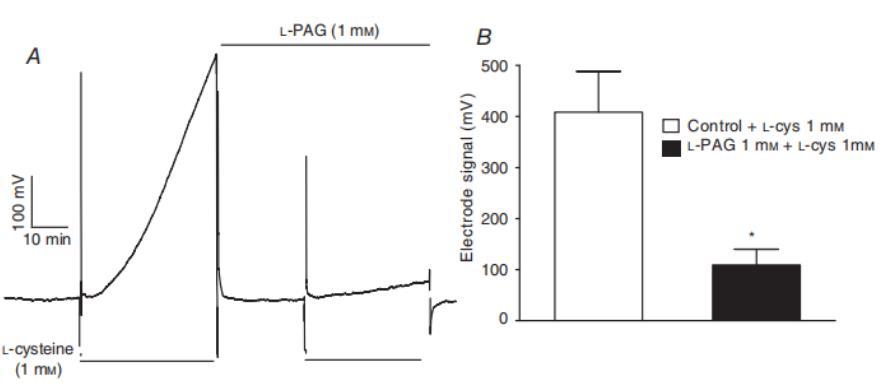
图3、L-PAG阻断大鼠肝脏的半胱氨酸依赖性硫化物合成。使用unisense硫化氢电极记录浸入1毫升含1mM半胱氨酸的PSS中的大鼠肝脏(175毫克)产生硫化物并释放到PSS中的情况。小瓶密封以防止硫化物流失,溶液预先用N2/CO2通气以去除O2,从而最大限度地减少硫化物氧化。A,在没有(左)和有(右)1mM L-PAG的情况下,1mM半胱氨酸释放硫化物的示例。B,在没有L-PAG和有L-PAG的情况下,半胱氨酸诱导硫化物释放的平均值。实验在成对组织中进行,结果与对照组织中观察到的硫化物释放量进行了归一化处理。
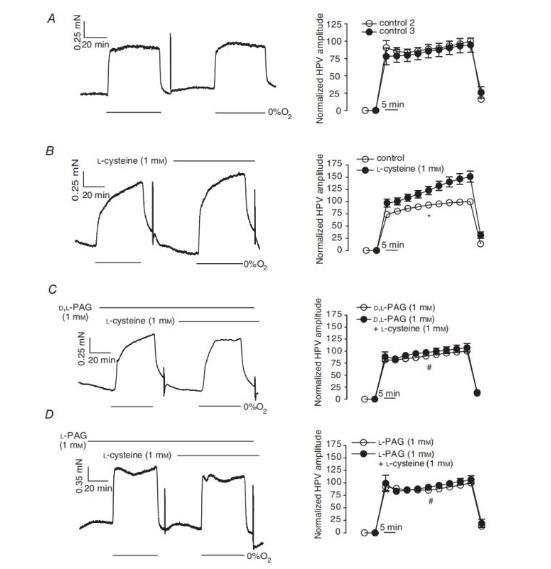
图4、在无PAG和有PAG的情况下,半胱氨酸对由0%O2气体诱发的HPV的影响。在对照组条件下(B,1mM,n=21)和D、L-PAG(C,1mM,n=9)或L-PAG(D,1mM,n=8)存在下,以及不含L-半胱氨酸的时间对照组条件下(A,n=14),IPA与L-半胱氨酸孵育30分钟之前(开圆圈)和之后(填充圆圈),HPV至0%O2。在每个面板中,左侧为平均数据,右侧为使用该方案进行实验的张力曲线。
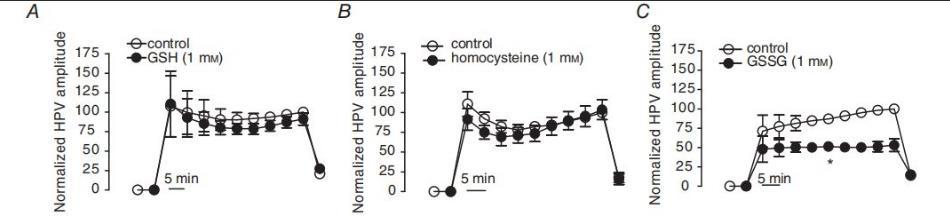
图5、硫化物前体GSH、GSSG和同型半胱氨酸对PAG存在和不存在时0%O2气体诱发的HPV的影响。在将IPAs与GSH(A,1mM,n=11)、GSSG(B,1mM,n=8)或同型半胱氨酸(C,1mM,n=5)孵育之前(空心圈)和之后(实心圈),HPV降至0%O2。
结论与展望
本研究探讨了硫化氢(H2S)是否通过其合成途径参与缺氧性肺血管收缩(HPV)的调节。研究使用离体大鼠肺动脉(IPAs),通过检测硫化氢前体(如半胱氨酸)和硫化氢合成抑制剂(如丙炔甘氨酸,PAG)对HPV的影响,来验证这一假设。研究结果不支持H2S在HPV中作为氧感受器的角色。尽管半胱氨酸可以通过CSE途径生成H2S来增强HPV和NPV,但在正常条件下,HPV并不依赖于H2S的合成。H2S和缺氧可能通过共同的机制(如增加活性氧水平)引起肺动脉收缩,而不是通过H2S的直接合成。通过RT-PCR检测到大鼠肺动脉中表达CSE和MST的mRNA,但未检测到CBS的表达,表明H2S的合成可能主要通过CSE途径。Unisense微电极系统在本研究中发挥了至关重要的作用,通过直接测量硫化氢的浓度变化,为研究H2S在肺动脉生理和病理过程中的作用提供了关键数据。这些数据不仅验证了实验假设,还帮助研究者深入理解了H2S合成途径在缺氧性肺血管收缩中的潜在角色。本研究为理解H2S在肺血管生理中的作用提供了新的见解,并对H2S是否参与HPV的调节提出了质疑。这一发现对研究缺氧性肺动脉高压的机制和潜在治疗靶点具有重要意义。