热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
4活体电化学抗蛋白质吸附
脑是一个复杂的系统,不仅有神经细胞、胶质细胞、小分子,还有生物大分子等,如蛋白质。在活体伏安法分析中,当微电极被植入到活体脑组织中时,电极会引发一系列的排异反应,从而影响电极的电化学分析性能。首先,在电极植入到活体的短时间内,蛋白质会非特异性吸附到电极表面,从而使电极的灵敏度迅速下降,响应时间变长。其次,在蛋白质吸附之后的几天内,中性粒细胞的吸附占据主导地位,在24~48 h后,中性粒细胞逐渐消失,并被单核细胞及巨噬细胞取代,最终在电极周围形成由巨噬细胞和胶原蛋白组成的无血管纤维囊(50~200μm),以致使物质的传输和电子转移受阻,最终导致电极灵敏度下降,甚至使电极失去响应。因此,避免蛋白质在电极表面的非特异性吸附(即抗生物污染),同时提高微电极的电化学性能对活体电化学的研究至关重要。
蛋白质吸附导致的一个结果是微电极必须在植入活体后进行校正,通常认为电极在植入到脑内一段时间后蛋白质吸附会达到稳定,所以选择在活体实验后进行电极校正,进而分析活体检测信号。但,活体后校正方法仍存在一些问题。首先,活体分析中使用的碳纤维电极比较脆,从脑中取出时很容易折断而无法进行后校正实验。其次,后校正方法的提出是基于在整个实验过程中电极的灵敏度保持不变,这就要求我们的电极在植入活体后,蛋白质能够迅速吸附并达到平衡。但,脑内蛋白质环境复杂,且蛋白质浓度在不同的生理和病理环境下可能发生变化。如干扰素和血小板衍生生长因子等在疾病中浓度会发生变化,这使得后校正方法对获取比较真实的活体检测信号存在一些偏差。
为了解决蛋白质吸附所造成的活体微电极的校准问题,研究人员提出了一些新的策略。Roberts等基于快速扫描伏安法(FSCV)建立了电极的原位校正方法,该方法借助电极背景中的非法拉第电流等参数建立模型,通过理论预测对电极进行校正。但该方法仅局限于FSCV,并且影响模型参数的因素较多,不同的实验室在使用时均需要重新测量参数。抗污材料修饰电极表面以减小蛋白质的非特异性吸附是解决电极灵敏度降低、活体后需要再次校正的另一策略。目前,Nafion,碱处理的醋酸纤维,PEDOT/Nafion等材料在一定程度上可减少蛋白质的非特异性吸附。Singh等系统的研究了Nafion、醋酸纤维、牵连蛋白修饰碳纤维电极(CFE)对单胺类递质检测结果的影响。他们发现不同材料修饰电极对电极的灵敏度、选择性及抗污染性能的影响也不同。有些材料有助于提高电极的选择性和灵敏度(如Nafion),有些材料则能提高电极的抗污染性能(如醋酸纤维、牵连蛋白)。虽然这些材料可通过控制厚度来提高电极的抗污染性能,但电极在活体实验后灵敏度仍然有较大的变化,仍需对电极进行活体后的校正。
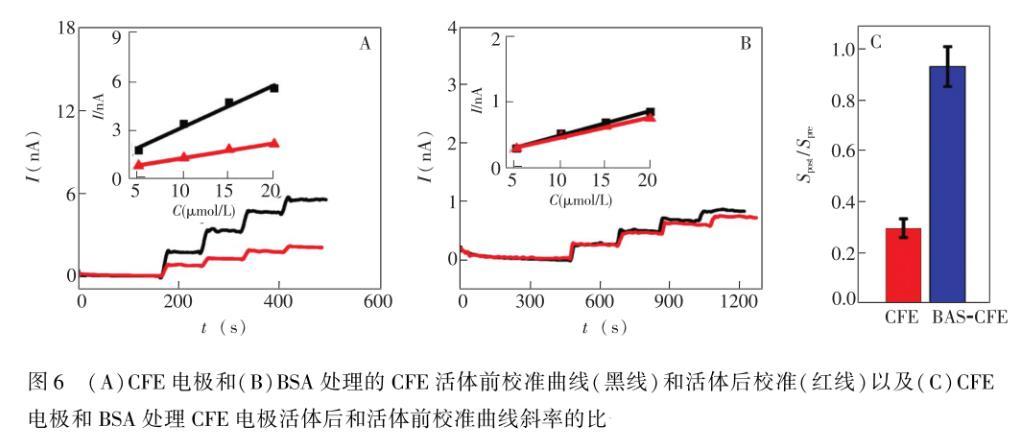
为了克服微电极必须在活体后校准的缺点,Liu等提出了用BSA处理微电极的方法进行活体原位分析,因他们发现微电极在BSA溶液中,电极的灵敏度会迅速降低,但BSA的浓度大于30 mg/mL时,电极的灵敏度不再下降,即使电极在与BSA电荷相反的蛋白质溶液中,电流响应也很稳定。基于此,他们在活体检测前用40 mg/mL BSA处理微电极,结果表明,活体前校准曲线的灵敏度和活体后校准曲线的灵敏度一致。并且,用BSA处理检测多巴胺(DA)的CFE和检测抗坏血酸(AA)的碳纳米管修饰CFE,发现这两种电极在活体前和活体后的校准曲线都是一致的,这说明了BSA处理的方法具有很好的普适性。该方法为活体电化学方法提供了可靠且简单的电极前校准的策略(图6)。
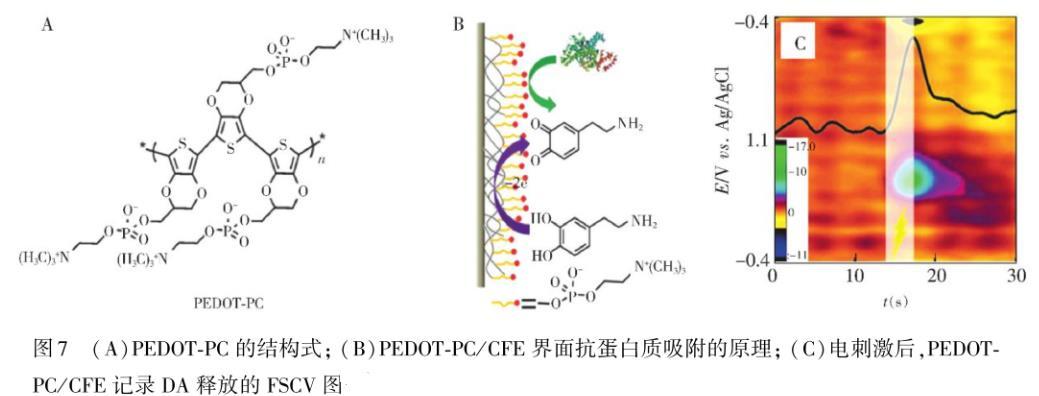
在提高微电极的抗蛋白吸附能力的同时保持微电极的灵敏度对活体检测极其重要,Liu等进一步设计了聚合物单体EDOT PC(两性离子磷酸胆碱官能化的乙烯二氧噻吩),并通过电化学聚合法将其可控地聚合在微电极表面,形成了具有类细胞膜结构的PEDOT PC超薄膜。其中由于PC端的电化学聚合自限制,形成了非常薄的PEDOT PC膜,保证了待检测物在膜内的快速传质。因此,PEDOT PC修饰的微电极不仅能够有效地抗蛋白质的非特异性吸附,而且能保持电极的检测灵敏度。利用PEDOT PC修饰的CFE准确监测了大鼠脑内KCl刺激,以及电刺激过程中DA的释放。该研究有效解决了微电极在活体原位分析中蛋白质吸附的关键问题,为更好地研究脑神经化学的分子机制奠定了重要基础(图7)。
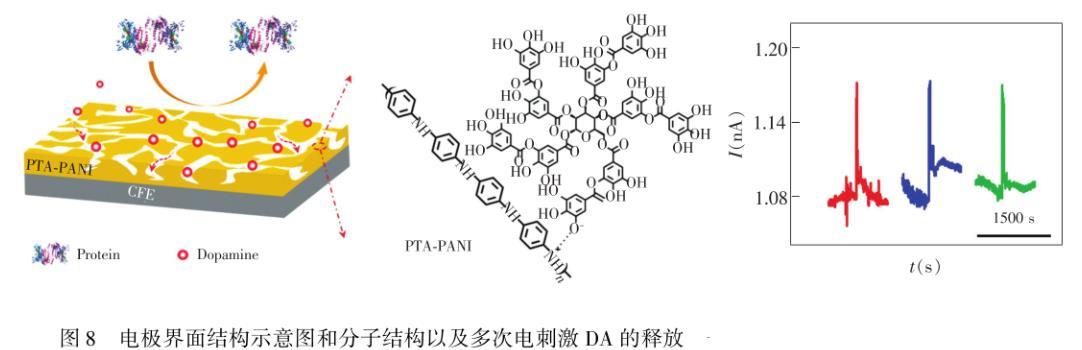
在微电极的表面构筑特殊结构也是有效克服蛋白质吸附造成分析性能下降的有效途徑。Zhou等在CFE表面构筑了一个高孔隙率的、有序的二氧化硅抗污染薄膜(SNM)。SNM能够有效地防止蛋白质进入到通道中引起CFE电极表面的生物污染,同时对O2的扩散具有高渗透性。活体实验表明:SNM/CFE可连续监测O2且能够保持对其高的分析灵敏度和快速响应。为了能够在构筑多孔结构的同时又具有高的亲水性能,Feng等报道了一种聚单宁酸(PTA)掺杂的纳米多孔导电聚苯胺(PANI)膜涂层,其中PANI构筑了多孔的结构,PTA的掺杂不仅使得PANI在中性溶液中保持了导电能力,而且PTA的多羟基使得构筑的PTA PANI多孔膜亲水性能更强,并对DA具有很强的富集能力。所制备的PTA PANI修饰的CFE表现出高的抗蛋白吸附的能力,活体前和活体后DA的校准曲线灵敏度基本一致,并且活体检测DA的释放具有高的稳定性(图8)。
在电化学分析中,蛋白质吸附对不同信号输出方式的影响不同,因此所使用的抗蛋白质吸附的方法也不同。Hao等发展了一种具有高抗蛋白质吸附性能的电位型传感器可用于直接监测鼠脑中pH的变化。该电极通过使用H+选择性膜(H+ISM)和含有增塑剂双(2乙基己基)癸二酸酯,H+离子载体三癸胺和离子交换剂钾四(4氯苯基)的聚氯乙烯聚合物基质制备。体外和体内研究均表明,CF H+ISEs电极具有很强的抗蛋白质吸附性能,CF H+ISE能够在活体检测后保持和活体前相同的灵敏度和可逆性(图9)。

此外,使用紅细胞膜修饰Ag/AgCl设计的参比电极也表现出优异的抗蛋白质吸附的性能,在活体内能提供稳定的电位并减小对组织的损伤。
5结论
在活体电化学分析中,微电极抗蛋白质吸附层的设计对提高活体检测结果的准确度,以及正确理解大脑功能的分子机制,都具有十分重要的意义。虽然在宏观电极上,目前有很多抗污染的方法可实现抗蛋白质的吸附,并能实现部分复杂样品,如血液等中的物质的分析,活体内通过电极界面设计也实现了部分物质的短时间实时分析,但活体分析抗蛋白质的吸附仍然存在很大的挑战。这主要是因为:(1)在宏观电极上可实现的策略,很难在微电极上实现,如表面微结构的调控,表面修饰等,因微电极表面需要更苛刻的合成条件和原位可控修饰技术;(2)抗蛋白质吸附策略物质依赖性强,不同信号读出方式,信号转换方式的抗蛋白质吸附策略也不一样,需依据不同信号读出方式(如电流法、电位法、电阻法等)和不同转换方式(如酶、适配体等)设计不同的抗蛋白质吸附的策略;(3)活体长期检测需要抗蛋白质膜具有更高的生物相容性和化学稳定性。相信,随着各学科的发展,如材料科学、微纳制备技术、信号转换和读出模式等,能更好地解决微电极的蛋白质吸附的问题,实现脑内化学物质的准确分析,更好地揭示脑神经科学的化学本质。