热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
肠道菌群是一个互相依存又互相制约的微生态系统。肠道微生态具有相对稳定性,正常情况下,肠道菌群的结构、种类、数量保持相对稳定,与宿主、外界环境处于相对平衡状态,对消化吸收、营养代谢、免疫以及抑制病原菌定植起重要作用。
结直肠癌(CRC)是世界第三常见的癌症类型,每年有近200万新病例,并且是全球癌症相关死亡的第二大原因。当肠道菌群平衡状态受年龄、饮食、抗菌药物及心理压力、应激等因素的影响失衡时,其中的有害菌或可通过引起慢性炎症、介导免疫应答、造成DNA损伤和产生某些代谢产物等途径,诱导并促进结直肠癌的发生发展。
诱发慢性炎性反应
肠道菌群可以通过诱导炎症或发挥免疫抑制作用而间接发挥促肿瘤作用。肠道菌群失调会引发肠黏膜免疫微环境的改变,进而导致肠黏膜炎症。持续性炎性反应大多数是结直肠癌发展不可或缺的前提。
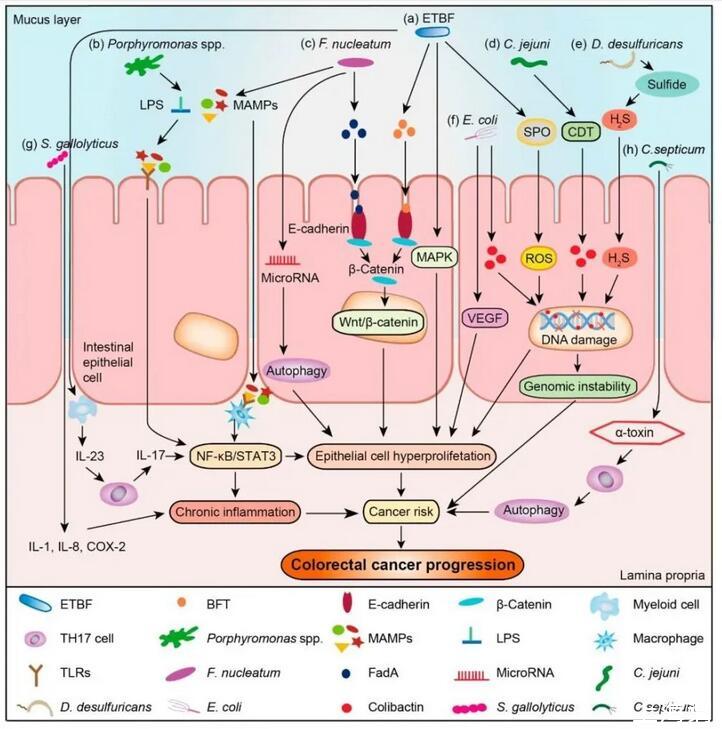
图1:大肠癌发生发展的细菌相关机制。(a)产肠毒素的脆弱芽孢杆菌(ETBF)激活相关信号通路;(b)卟啉单胞菌属的脂多糖(LPS)作用路径;(c)具核梭杆菌的梭杆菌粘附素A(FadA)结合肠上皮细胞,产生促炎作用;(d)空肠弯曲杆菌产生细胞致死膨胀毒素(CDT)促进结肠直肠癌发生;(e)脱硫细菌可将硫或含硫化合物还原成硫化氢(H2S);(f)含有pks岛的大肠杆菌产生大肠杆菌素,诱导DNA双链断裂;(g)溶没食子链球菌产生促进炎性因子;(h)败血梭菌可产生α-毒素。
产肠毒素的脆弱芽孢杆菌(Enterotoxigenic Bacteroides Fragilis,ETBF)分泌脆弱芽孢杆菌毒素(bacteroides fragilis toxin,BFT),与宿主细胞的E-钙粘蛋白和β-连环蛋白相互作用(图1a),激活Wnt/β-连环蛋白信号通路,并驱动与凋亡、细胞增殖或转化相关的基因转录。同时,BFT可以激活丝裂原活化蛋白激酶(MAPK)信号通路,增强上皮细胞不受控制的增殖。此外,ETBF通过核因子-κB(NF-κB)/信号转导和转录激活因子3(STAT3)途径刺激IL-17和IL-23的产生,并诱导结肠上皮中的黏膜免疫反应,促进结肠上皮细胞的增殖和代谢。
NF-κB是先天性免疫和炎性反应的关键调控分子,与肠道肿瘤样病变的起始和发展密切相关,肠上皮细胞NF-κB通路中的IKK-β基因被抑制后,结直肠癌的发生率显著降低。
具核梭杆菌(Fusobacterium nucleatum)产生的梭杆菌粘附素A(FadA)可以结合肠上皮细胞的E-钙粘蛋白,激活β-连环蛋白,导致不受控制的细胞生长,获得干细胞样表型(图1c)。此外,具核梭状芽孢杆菌通过激活调节性微小RNA来调节肠上皮细胞的自噬。具核梭状芽孢杆菌还通过TLRs识别MAMPs,导致NF-κB或STAT3途径的激活,并加速CRC的发展,从而产生促炎作用。
STAT3途径激活后,增加结肠上皮对结肠炎易感性的同时,还可通过介导IL-6和IL-1的分泌从而提高结直肠癌的发生率。
肠道菌群失调介导的慢性和低炎症状态,主要与其产生的细胞因子有关。没食子链球菌S.gallolyticus可促进炎性因子如IL-1、IL-8和环氧化酶-2(COX-2)的产生,从而通过慢性炎症加速CRC的发展(图1g)。败血梭菌C.septicum可产生α-毒素,诱导肿瘤微环境中的中性粒细胞凋亡,从而下调肿瘤免疫反应,加速结直肠癌的发展(图1h)。
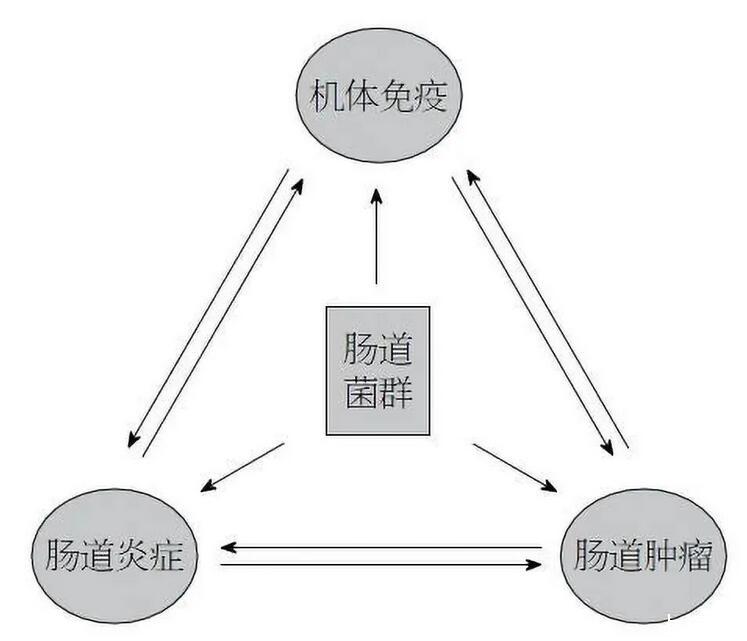
图二:肠道菌群与炎症、免疫、肿瘤之间的关系示意图。肠道菌群失调可通过免疫应答参与肿瘤的形成,炎症、免疫、肿瘤之间存在着相互关联的“三角纽带”关系,癌症的发生发展与炎症密切相关,炎症的发生又往往伴随有免疫能力的改变;而肠道菌群则在这一关系中发挥着“立交桥”式的功能。
肠道表观遗传学的改变
特定肠道病原体通过多种机制(包括诱导炎性反应、活性氧自由基的产生、DNA损伤和DNA修复过程的破坏等)引起肠道表观遗传学的改变,促进癌变的发生。
某些大肠杆菌含有“pks”基因岛,它编码被称为大肠杆菌素的杂合聚酮化合物。大肠杆菌毒素可以通过引起双链DNA断裂直接攻击宿主DNA,导致肠道表皮细胞基因组不稳定,导致突变频率和CRC风险增加。
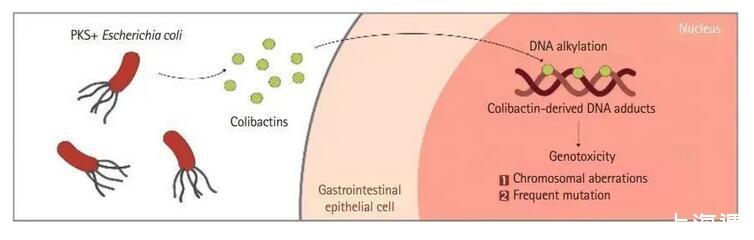
图三:pks+大肠杆菌诱导产生DNA断裂示意图;PKS:聚酮合酶。pks+大肠杆菌通过产生一种名为Colibactin的毒素,可诱导宿主细胞双链DNA的断裂,从而激活DNA损伤的信号级联,导致慢性有丝分裂、染色体畸变和基因突变频率的增加,引发结直肠癌发病早期遗传事件。
分离自CRC患者的大肠杆菌,大肠杆菌素的编码基因存在过度表达。此外,大肠杆菌还产生其他毒素,如细胞致死膨胀毒素(cyto-lethal distending toxin,CDT),可诱导显著的细胞膨胀,最终导致细胞死亡;诱导转化上皮细胞功能障碍。这些大肠杆菌还可以通过增加血管内皮生长因子(VEGF)的产生,促进血管内皮细胞迁移,增加血管通透性。
不是所有的大肠杆菌都产生毒素,所以,大肠杆菌的致癌性可能具体取决于毒素基因的水平,而不是大肠杆菌的总丰度。大肠杆菌的毒素基因比完整大肠杆菌更适合作为CRC生物标记。
其他可能影响肠道上皮细胞DNA双链的菌群还有:(1)空肠弯曲杆菌C.jejuni可产生细胞致死膨胀毒素(CDT),诱导DNA双链断裂,导致诱变和染色体不稳定;(2)某些脱硫细菌可将硫或含硫化合物还原成硫化氢(H2S),当硫化氢浓度高时,可促进氧化和DNA损伤;(3)粪肠球菌菌株能够产生诱导DNA损伤和基因组不稳定的活性氧,诱导黏膜巨噬细胞产生可扩散的致染色体断裂剂,介导DNA损伤。(4)脆弱拟杆菌毒素可促进某些细胞因子和趋化因子(如IL-8)的表达,加剧活性氧介导的DNA损伤。
肠道菌群自身及代谢产物的直接促癌作用
在正常的结肠中,肠道菌群产生大量的代谢物。其中维生素K、生物素和短链脂肪酸(SCFAs)等,对维持结肠微环境的稳态至关重要。如果没有肠道菌群,结肠上皮会发生自噬,无法维持其正常结构和功能。一些肠道菌群异常代谢物在结直肠癌的发病机理和免疫微环境中起着关键作用,如次级胆汁酸等。
失调肠道菌群的代谢能力发生了改变,释放多种细菌毒素。有些肠道细菌本身就是致癌物。目前已知的肠道致癌细菌包括胆管癌相关的伤寒沙门氏菌(Salmonella typhi)以及与原发性肝癌、胃癌相关的幽门螺杆菌(Helicobacter spp.)等。其中,幽门螺杆菌已经被世界卫生组织确定为Ⅰ类致癌物。
一些肠道菌群的代谢物为致癌物,如部分肠道微生物能通过门静脉系统将肝脏产生的初级胆汁酸转化成脱氧胆酸等次级胆汁酸,从而引起DNA损伤、肝毒性和癌性病变。
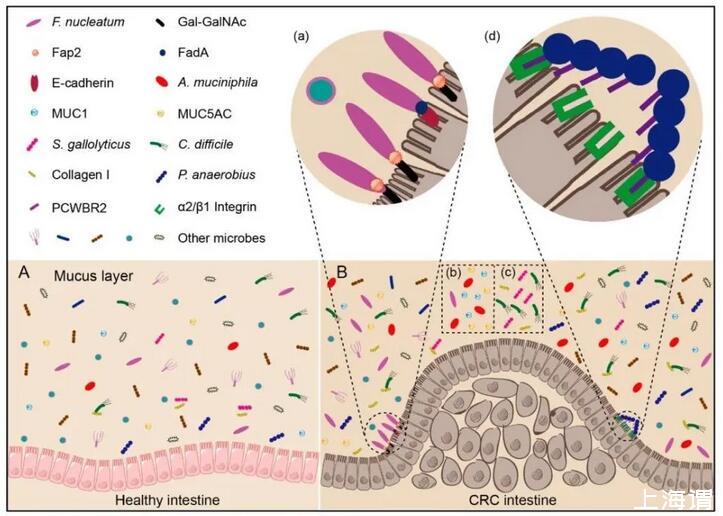
图四:结直肠癌组织中特定细菌富集的潜在机制。(A)健康的肠道。(B)CRC肠道:(a)D-galactose-β(1–3)-N-acetyl-D-galactosamine(Gal-GalNAc)在CRC细胞中过表达,具核梭状芽孢杆菌的Fap2可直接结合于其上,导致具核梭状芽孢杆菌在CRC组织中的特异性积累;另一方面,FadA可以帮助具核梭状芽孢杆菌粘附肠上皮细胞;(b)结肠直肠癌患者的肠中MUC1(粘蛋白1)和MUC5AC(粘蛋白5AC)增加。由于可利用的底物增加,因此结直肠癌患者肠道中粘蛋白嗜酸乳杆菌的丰度增加;(c)结肠直肠癌患者的肠中胶原I增加。解镓链球菌S.gallolyticus和艰难梭菌C.difficile可与I型胶原结合,导致结肠直肠癌患者肠道中致病菌的丰度增加;(d)厌氧菌P.anaerobius的表面蛋白PCWBR2可以通过α2/β1整合素直接与结直肠上皮细胞相互作用,α2/β1整合素在结直肠癌组织中经常过表达。
未来展望
总结来说,肠道菌群失衡影响结直肠癌发生发展可能有三种机制:(1)刺激免疫系统,从而引发慢性炎症,导致或促进上皮细胞过度增殖、癌基因激活和血管生成;(2)直接或间接损伤宿主DNA,导致突变和基因组不稳定;(3)通过激活NF-κB或β-连环蛋白信号影响细胞增殖和细胞凋亡。
如果说人类与结直肠癌的斗争是一场“持久战”,那么,失衡的肠道微生态引起的肿瘤微环境就是战场的前线。改变这些异常对于结直肠癌的诊断、预防和治疗具有潜在的应用前景:(1)结直肠癌患者肠道中富集的菌株,可被视为生物标志物,有可能开发出针对性的结直肠癌的诊断方法;(2)富含于CRC的致癌细菌,或可开发针对它们的药物以减少其在CRC患者中的丰度,从而抑制CRC的发展。
图五:肠道微生物群在CRC治疗中作为筛选、预后和预测生物标志物的潜在临床应用,及其在CRC预防、治疗中的可能用途。
尽管已有较多的研究成果,但是目前对于肠道菌群在结直肠癌中具体的作用机制尚未充分阐明。需要更多应用理论模型,来研究肠道菌群与宿主之间复杂的相互作用,以期为今后结直肠癌的预防和诊疗提供新思路和新方法。
参考文献
[1]Sánchez-Alcoholado L,Ramos-Molina B,Otero A,et al.The role of the gut microbiome in colorectal cancer development and therapy response[J].Cancers,2020,12(6):1406.
[2]Song M,Chan A T,Sun J.Influence of the gut microbiome,diet,and environment on risk of colorectal cancer[J].Gastroenterology,2020,158(2):322-340.
[3]Dahmus J D,Kotler D L,Kastenberg D M,et al.The gut microbiome and colorectal cancer:a review of bacterial pathogenesis[J].Journal of gastrointestinal oncology,2018,9(4):769.