热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
近年来,由于人们对气候变化的认识不断提高,对海洋碳通量的研究受到重视,但沿海生态系统仍然是这方面尚未开发的领域之一。在这项研究中,通过评估净生态系统生产量和总生态系统生产量(NEP和GEP)以及CO2交换率(净生态系统交换量,NEE),研究了营养海岸生态系统中碳通量的动态。为了估算NEP和GEP,2007年6月20日至7月20日,在韩国光洋湾沿不同栖息地类型(鳗草和大型藻床、浅层和深层沉积以及深层岩石海岸)测量了群落产量和呼吸。植被区的生态系统产量明显高于其他生境类型。具体而言,鳗草床具有最高的每日GEP(6.97±0.02 g C m-2 d-1),具有大量生物量和较高的鳗草生产力,而外部大型藻类植被具有最低的GEP(0.97±0.04 g C m-2 d-1)。此外,大型藻类植被由于其最高的P:R比(2.33),显示出最高的每日NEP(3.31±0.45 g C m-2 d-1)。此外,根据NEE数据,鹅草床通过空气-海水界面充当CO2汇,碳汇率为0.63 mg C m-2 d-1。总的来说,我们发现植被系统(沼泽草和大型藻类床)的生态系统产量极高,根据我们的碳通量箱模型概念图,与非植被系统相比,植被系统所占面积相对较小。这些结果表明,植被生态系统通过沿海初级生产力对无机碳的捕获效率显著提高。
海洋是全球最大的碳库,共含有约38000亿吨碳,约为大气碳总量的60倍,约为陆地生物圈和土壤碳总量的10倍(Ciais等人,2013)。此外,地球碳库的通量与海洋过程有关,主要与它们与陆地生态系统的联系有关。在这些海洋学过程中,海洋初级生产者的有机碳固定和大气-海洋界面的碳交换约占人为碳的50%(Sabine et al.2004)。因此,远洋生态系统的初级生产力占全球碳汇的很大比例,目前正在与陆地生态系统一起积极研究这一专题。相比之下,对沿海生态系统碳研究的关注较少,可能是因为它们只占总海洋面积的一小部分(约7%)(Borges et al.2005)。此外,陆地外来有机物质的输入和自养生物(如维管植物、大型藻类、浮游植物和微型底栖生物)的高密度增加了沿海生态系统的复杂性,而在公海通常只考虑浮游植物组合。因此,更难全面描述沿海生态系统中的碳循环,如果我们要更好地理解这些循环,就需要更详细地描述对这些循环重要的过程(Mcleod et al.2011)。
光合作用固定的碳可以通过几种途径,其中一种途径是埋藏在沉积物下面。虽然由于初级生产力较高,沿海地区的碳a埋藏率较高,但大多数以自养生物为主的沿海生态系统(如河口、红树林和盐沼)通常由于外来有机碳超载而成为大气的净CO2源(Chen和Borges,2009年,Mcleod等人,2011年)。事实上,由于光合作用和呼吸的不同来源、人为输入的碳和养分以及植被组合的异质性,河口和近岸生态系统的CO2排放范围特别广(Borges et al.2005,Laruelle et al.2010)。在这些系统中,水生植被的高生物量可能通过在光合作用期间将无机碳转化为有机碳,在沿海碳固存中发挥关键作用(Mcleod et al.2011,Fourqurean et al.2012)。因此,这些栖息地通常被称为“热点”,因为它们的高碳固存率与快速初级生产相关。因此,植被海岸生态系统中的全球碳埋藏预算估计约为111 Tg C y-1,约占海洋中埋藏碳总量的一半(Duarte et al.2005),是海洋碳固存总量的重要组成部分。因此,了解自养碳固定率对于更好地估计沿海水域的净碳通量至关重要。
在与海洋碳通量相关的重要因素海洋过程中,CO2气体交换是与海洋生态系统碳通量相关的净生态系统交换(NEE)参数(Lovett et al.2006)。NEE定义了单个生物体和种群,甚至整个群落的固定和呼吸CO2,对于理解沿海碳循环非常重要。因此,有必要基于大气-海水界面碳通量参数的实际测量来研究沿海碳循环,以了解植被在沿海碳循环中的作用。
尽管碳质量平衡很重要,但植被海岸生态系统中的碳质量平衡很难解释,因为构建适当的碳模型是一项艰巨的工作(Ver等人,1999年)。相比之下,已经为公海开发了许多碳循环的概念模型(Randerson等人,2002年,Lovett等人,2006年)。这些模型根据无机碳和有机碳转化过程中涉及的几个生物和化学参数来估算沿海碳循环。然而,在沿海地区通过光合作用合成的有机碳可以沉入底栖生物,在那里可以被掩埋或从沿海生态系统运输到近海水域。因此,可以通过测量与碳固存相关的组成部分来估算无机碳和有机碳的预算,例如生态系统净产量(NEP)、外来碳输入量、富碳物质从海岸的运输以及底栖生物的碳埋率(Duarte et al.2005)。
基于这些观点,我们将重点放在高产沿海生态系统中的生态系统生产(NEP和生态系统总产量[GEP])和NEE上,以估算自养生物驱动的碳通量。在这项研究中,定量估计了韩国南部海岸光阳湾海岸生态系统中的GEP、NEP和NEE,其中存在三个底栖自养生物群落(鳗草、大型藻类和微型底栖生物)和一个浮游植物群落。具体而言,本研究的目的是1)通过各种自养生物的光合碳吸收和呼吸来估算GEP和NEP,2)估算亚生态系统类型(鳗草床、大型藻类床、未种植的浅层沉积物、深层沉积物和深层岩石栖息地)的NEE,(3)构建了当地植被海岸生态系统内不同植被类型CO2通量的概念箱模型。
研究地点描述
光洋湾是一个浅层半封闭系统,位于朝鲜半岛南部海岸,其水文受通过狭窄海峡(约4 km宽)与近海水域交换的控制(图1)。该湾的最大潮差约为4 m。浅海岸地区(水深小于10 m)占整个光洋湾地区的50%以上,主要由淤泥和粘土组成的沉积物构成。尽管位于海湾西南角的哈东燃煤电厂和Yulchon工业综合体也是碳、养分和污染物的潜在来源,但陆地外来碳和养分的主要来源还是来自Sumjin河(图1)。光阳湾的自养群落由浮游植物、微型底栖生物、鳗草(Zostera marina L.)和几种大型藻类组成,所有这些藻类在整个海湾中分布不均匀(Kim等人,1998年,Kim和Choi,2004年)。
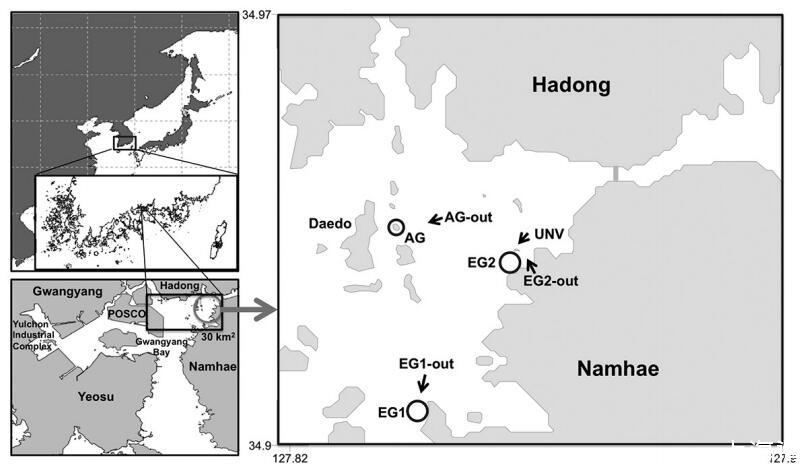
图1:。研究地点位于韩国南部海岸光洋湾。子系统通过自养生物的植被类型和群落组成进行区分,自养生物有植被:AG(大型藻类和浮游植物)和EG(鳗草、浮游植物和微型底栖生物),无植被:AG out(浮游植物)、EG out(浮游植物和微型底栖生物)和UNV(浮游植物和微型底栖生物)。
在本研究中,根据初级生产者的主要类型和基质特征,将海湾生态系统分为五个栖息地。具体而言,这些是1)鳗草层(EG),2)大型藻类林(AG),3)深层沉积栖息地(UNV;>10 m),4)浅层沉积栖息地(EG out;≤10 m)和5)深岩礁(AG out)(图1)。利用航拍照片(Daum©、Samah©、Goyang、Korea)的图像分析和船上调查相结合的方法,估算了这五个栖息地在当地箱形比例尺(30 km2)内的总面积。这些区域为1)鳗草层=1.9 km2,2)大型藻类林=1.6 km2,3)深层沉积栖息地=16.8 km2,4)浅层沉积栖息地=6.3 km2,以及5)深层岩礁=3.4 km2。随后,选择了两个鳗草床(EG1和EG2),以估算鳗草、浮游植物和微型底栖生物的初级生产力。选择一个大型藻类林分(AG)来确定每个大型藻类物种和浮游植物的空间分布,并估计其个体初级生产力。还选择了四个非植被化地点、两个浅层沉积栖息地(EG1-out和EG2-out)、一个深部沉积栖息地(UNV)和一个深部岩礁(AG-out),并估算了常驻自养生物的初级生产力。最后,我们根据2007年6月20日至7月20日期间对自养生物的生产力估计,开发了海湾碳通量的概念箱模型。
日辐射和环境因素
使用LI-COR水下光合有效辐射(标准杆数)传感器(LI-192)在四个采样点(EG1、EG2、AG和UNV)的底栖生物附近连续记录下涌辐照度,该传感器连接至数据记录器(LI-1400;LI-COR Inc.,Lincoln,NE,USA),该记录器在6月20日至21日的原位孵化实验期间部署,并使用LI-COR传感器在水面(空气)上方标准杆数传感器(LI-190)。然后使用比尔定律计算水柱内标准杆数的衰减系数,以找到每个栖息地中自养生物可用的有效辐照度。在鳗草冠层(约1米深)测得的辐照度用于计算鳗草产量,在大型藻类植被最丰富的水域(约4米深)测得的辐照度用于计算大型藻类产量。在考虑光衰减系数的同时,使用空气辐照度数据计算不同深度的浮游植物产量(Kim等人,2013a)。此外,还利用沉积物表面的辐照度剖面计算了微型底栖生物的生产力。
在海水采样期间,测量了水温、盐度和风速,并将其用于估算远洋生产力和与大气的CO2气体交换。具体而言,温度和盐度分别使用流浪汉吊坠式温度记录器(美国马萨诸塞州伯恩市安思特计算机公司)和8410-a便携式盐度计(精度±0.003;英国汉普郡OSIL)进行测量。风速数据是从距离研究地点约14公里的气象观测中获得的。
鳗草和大型藻类生物量
在13至15个样方(0.063-m2)范围内估计鳗草枝密度,这些样方由一名戴水肺潜水员随意放置在每个鳗草床内。使用每个样方内单个嫩枝重量的平均值估计这些样品的鳗草地上生物量,使用DT-X数字回声测深仪(美国华盛顿州西雅图Biosonics Inc.)测定海湾内鳗草床的总面积,并使用高频传感器(420 kHz单波束)收集数据。回声测深仪数据显示,鳗草在研究地点之间均匀分布(Kim等人,2008年)。此外,通过收集0.063平方米样方内的所有大型藻类来量化大型藻类物种的生物量,这些样方沿垂直于AG现场海岸线的三条样带线以2米的间隔放置(n=18个样方)。采集样本后,测量湿重以估计单个物种的分布,并根据不同物种的总和确定样本中大型藻类的生物量。然后,根据大型藻类林分的总面积以及每个物种的质量和相对丰度,估算海湾大型藻类的总生物量。
鳗草和大型藻类的生产力和呼吸
为了估算个别鳗草和大型藻类的光合作用和呼吸速率,在晴朗的日子(2007年6月20日),在海湾东北部(EG1附近的海滩)进行了原位孵化实验。一名戴水肺的潜水员从每个栖息地采集了三份鳗草(Zostera marina)和六种最常见的大型藻类的重复样品(n=3),并将其放在不透明的桶中移到孵化点,以最大程度地减少光照。在手动去除附生生物后,选择了鳗草芽的叶#3(从最年轻的叶开始计算)和大型藻类的完整叶状体,在不同光照强度下进行原位培养,因为第三叶的光合作用最接近平均个体生产力(未公布数据)。具体而言,培养瓶(约280毫升的细胞培养瓶;康宁公司,美国纽约州康宁市)是通过向每个培养瓶中注入20µm过滤的海水(来自鳗草(EG-2)或大型藻类(AG)收集点)并向其接种10µCi的NaH14CO3来单独制备的。然后将瓶子包裹在中性密度屏幕的各层中,以产生七种不同的透光强度(即0、13、17、30、43、67和100%的环境光)(Kim等人2013a),以构建P-i曲线。该系统在水中自然具有浮力,并保持在约10 cm的深度,从而确保稳定的环境温度,并允许波浪自然搅动瓶子,以减少边界层的形成。该深度的光强度是使用带有LI-192水下量子传感器的LI-1400数据记录器测量的。将每个样品培养3小时,这足以测量氧气的产生和消耗(未公布的数据),同时最大限度地减少瓶子效应,如营养耗尽和/或样品活力的退化(Mateo等人,2001年)。在原位培养后,通过添加4%中性福尔马林停止每个瓶子内的光合活性。从每个瓶子中取出小块14C标记的组织(约20 mg),并添加到单个闪烁小瓶(20 mL)中,以分析新合成的有机碳的放射性。在这里,首先用0.5 M NaOH和5%Triton X-100在黑暗中溶解植物组织,然后用H2O2氧化,添加10 mL硫酸面粉闪烁鸡尾酒(Perkinlemer,Norwalk,CT,USA)。然后使用液体闪烁计数器测定每个样品的放射性(Tri-Carb 2100 TR;Packard Instruments Co.,Meriden,CT,USA)(Gómez et al.2007)。随后,使用Penhale(1977)推导的方程式计算每个样品的碳吸收量。为了计算碳吸收率,采用海水碳化学分析的标准方法测定海水中的总溶解无机碳(CT)(Dickson et al.2007)。从这些短期孵化实验中获得的结果测量了总光合作用(Mateo等人,2001年)。暗呼吸(Rd)是在现场条件下,使用光学氧传感器点测量氧气消耗率,该点与Fibox 3(PreSens,GmbH,Regensburg,Germany)有光纤连接(Kim et al.2013b)。具体而言,呼吸通过在黑暗条件下孵育2小时后的耗氧量计算,在将氧气转换为碳单位时使用呼吸商1.0。
浮游植物的生产力和呼吸
为了估算浮游植物对生态系统生产的贡献,利用14C技术测定了鳗草层(EG1和EG2)和深岩礁(AG out)的浮游植物初级产量。海水样品通过200µm网格过滤,以去除大型浮游动物和悬浮颗粒。然后将产生的水和浮游植物添加到孵化瓶(约80毫升的细胞培养瓶;康宁)中,像大型藻类和鳗草一样,将其包裹在筛网层中。每个瓶子接种10µCi的NaH14CO3,然后在原地地表水中培养3小时。培养后,使用极低真空压力(<50 mm Hg)通过玻璃膜过滤器过滤样品(Whatman GF/F;英国白金汉郡GE Healthcare Ltd.)。在分析放射性之前,向每个过滤器中添加UltimaGold(Perkinlemer)闪烁鸡尾酒(10 mL)。使用液体闪烁计数器测量合成颗粒碳的放射性。然后使用Strickland和Parsons(1972)推导的方程计算碳吸收。为了计算碳吸收率,采用海水碳化学分析的标准方法测定海水中的CT(Dickson等人,2007年)。考虑到真光带内标准杆数的衰减系数,通过整合整个深度产量计算浮游植物的面积群落产量(Taylor 1999)。我们从文献调查中考虑了水柱中的每日社区呼吸(CR),因为氧气消耗率没有使用氧气计检测,氧气计与电化学和光学氧气探针相连,约占每日总产量的73%(Williams 1998)。
底栖微生物垫的生产力和呼吸
为了估算软沉积物中微型底栖生物的初级生产力和呼吸,从植被覆盖的浅层沉积(EG2-in)、非植被覆盖的浅层沉积(EG2-out)和非植被覆盖的深层沉积(UNV)区域采集了沉积物样品。在这项工作中,一名戴水肺的潜水员将透明的丙烯酸管(内径5 cm)插入约12 cm深的沉积物中,而不会干扰表层沉积物。然后将每个采样点的五个完整沉积物岩芯快速移到实验室(5小时内),在温度、盐度和明暗循环(分别为23°C、S=32和12:12 LD循环)的模拟现场条件下进行保存。此外,样品适应日光荧光灯(20µmol光子m-2 s-1)提供的低光照水平。通过使用克拉克型氧微电极(尖端直径25µm;OX-25;Unisense,Aarhus,Denmark)获得的垂直氧微文件测量光合作用产生的氧气,并基于暴露于七种不同光照强度20分钟后的每个氧微文件计算微生物垫的净面积生产和呼吸,由卤素照明器提供(KL 2500 LCD;德国美因茨肖特)(Kühl等人,1996年)。基于Fick的一维扩散方程第一定律,考虑沿盐度和温度的扩散系数,将净群落产量(NCP)和呼吸(CR)计算为穿过扩散边界层的向上和向下O2通量之和(Jørgensen和Revsbech 1985),使用光合(1.2)和呼吸商(1.0)将氧基NCP和CR转换为碳基单位。
净/总群落和生态系统生产
通过使用Platt等人(1980)的抑制模型拟合光响应曲线,估算了鳗草、大型藻类和微藻群落的光合参数(最大光合速率,PB max;光合效率,α;饱和辐照度,Ek)。这些参数的平均值和每小时辐照度剖面再次被替换到Platt等人(1980)的数学公式中,以计算社区生产力(附录1)。还考虑了植被的面积生物量,以计算每日的面积群落产量。在鳗草冠层中心(1米深)和大型藻类物种主要分布的水域(3米深)获得辐照度数据,以估计每个物种的产量。为了估算底栖微生物垫的群落产量,还对非植被和浅层沉积生境的深度<3 m以及深层沉积生境的深度>3 m进行了估算。利用不同深度和每个地点的辐照度数据,在24小时内对这些数据进行汇总,得出每日群落产量(Kim et al.2013a)。此外,由自养生物驱动的NCP/总社区生产(GCP)的整体整合代表了NEP/GEP。
海水pCO2和NEE的测定(CO2交换)
为了确定海水中的碳化学,中午左右从每个地点采集了表层海水样本。将样品快速转移到500 mL Pyrex瓶中,不引入气泡,然后立即用100µL饱和HgCl2中毒(Dickson等人,2007年)。在VINDTA系统(德国基尔马里安达)中,在实验室使用库仑滴定法和电位滴定法测定总溶解无机碳(CT)浓度和总碱度(AT)。每天对照已知CT和AT值的海水参考材料检查CT和AT测量的准确性和精密度(由美国加利福尼亚州圣地亚哥斯克里普斯海洋学研究所A.Dickson认证)。CT的测量精度约为±2µmol kg-1,AT的测量精度约为±1.5µmol kg-1。海水分压(pCO2)值是根据测量的CT和AT值,使用Mehrbach等人(1973)的碳酸离解常数计算得出的。这组热力学常数已证明与实验室(Lee et al.1996,Millero et al.2006)和现场(Lee et al.2000,Millero et al.2002)对海洋温度和盐度范围内碳参数的测量结果最为一致。使用CO2交换=k×s×(pCO2空气-pCO2海水)的方程计算海气界面的CO2交换,其中k是气体传输速度(cm h-1),s是CO2在海水中的溶解度,pCO2空气和pCO2海水是空气和海水之间CO2分压的差(Weiss 1974)。空气中的CO2分压由济州岛Kosan的年平均值确定(386 ppmv)。气体传输速度计算为k=0.31×U102×(Sc/660)-0.5,其中U10是10 m高度处的风速(m s-1),Sc是给定温度和水密度下评估的施密特数【Sc=2073.1-125.62(温度)+3.6276×(温度)2-0.043219×(温度)(Jähne等人,1987年,Wanninkhof 1992年)。