热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
渗透性沉积物在大陆架上很常见,是海洋生物地球化学循环的重要贡献者。渗透性沉积物中的有机物以微藻为主,微藻作为真核生物,对细菌和古细菌有不同的厌氧代谢途径。在这里,我们对流动反应器实验进行了分析,表明溶解无机碳主要是由厌氧真核生物代谢活动产生的。在我们的实验中,溶解无机碳的厌氧产生始终伴随着大量溶解H2的产生,这表明存在发酵。在使用广谱杀菌抗生素后,溶解无机碳和H2的产生持续存在,但在使用甲硝唑治疗后停止。甲硝唑抑制真核生物发酵产氢的铁氧还蛋白/氢化酶途径,表明该途径是产氢和溶解无机碳的来源。代谢组学分析表明,在缺氧开始时,脂质生成量大幅增加,这与微藻缺氧黑暗发酵的记录路径一致。细胞计数显示沉积物中以微藻为主。在从研究地点分离的硅藻(Fragilariopsis sp.)和绿藻(Pyramimonas)的黑暗缺氧培养物中观察到H2生成,证实了微藻进行发酵的假设。我们得出结论,微藻黑暗发酵可能是渗透性沉积物中重要的节能途径。
微藻在全球范围内普遍存在于透光沉积物中,其生物量通常超过上覆水域中的浮游植物1。在渗透性(砂质)沉积物中,其生物量可能占有机碳库的10–40%,基于先前报告的碳与叶绿素a的比率2,3和高比例的功能性叶绿素4。相比之下,此前有报道称,细菌生物量占砂质沉积物中有机碳库的比例小于10%。这也与微藻在调节此类沉积物中碳流方面的优势6相一致。考虑到微藻的生物量很高,与细菌相比,可以合理预计微藻将承担大部分碳矿化和能量生成途径。尽管如此,人们仍然普遍认为细菌发酵和硫酸盐还原是缺氧渗透沉淀物中溶解无机碳(DIC)产生的主要机制7。令人惊讶的是,尚未对新采集的沙子中的电子受体利用以及微藻在这些过程中的作用进行系统研究8。
渗透性沉积物的动态性质意味着微藻通常均匀分布在≥砂内15 cm,黑暗缺氧条件将盛行1,6。研究表明,混合在深色沉积物中的微藻可以在很长一段时间内(半衰期为6-22天)保持活性,突出了它们对这种动态环境的适应能力9。然而,它们如何在光照和氧气波动下生存的代谢基础尚不清楚。硝酸盐呼吸此前已被证明能维持光合真核生物无菌培养物在黑暗缺氧条件下的存活10;然而,硝酸盐呼吸是否是环境中的一种相关策略仍有待确定,它不太可能足以支持低硝酸盐浓度寡营养系统中的微藻种群。发酵是微生物用来将碳矿化与能量生成结合起来的另一种策略。尽管一些微藻已被证明在黑暗缺氧条件下进行发酵,例如,绿藻11,12-迄今为止,还没有研究量化这一点在环境中的重要性。
在这项工作中,我们首次研究了渗透性沉积物中缺氧微藻代谢的重要性。我们将流动反应器(FTR)实验与微生物学方法相结合,以确定渗透性沉积物中DIC产生的主要因素和途径。我们表明,微藻黑暗发酵是主要的代谢途径,这是首次在环境中记录到这一点。
光营养真核生物主导代谢
我们最初使用在菲利普港湾(澳大利亚)和科特明德(丹麦)收集的沉积物,比较了DIC生成率和电子受体利用率。我们使用FTRs比较砂柱入口和出口处的溶质浓度,以计算体积速率。在缺氧条件下添加50µM 15NO3−,FTR实验表明,与DIC生成相比,硝酸盐还原为亚硝酸盐和N2的速率较低;在澳大利亚和丹麦样本中,它们只能占DIC产量的不到10%(图1a,b)。DIC生成率和硝酸盐还原率之间的差距与Evrard等人201313和Marchant等人201614之前的观察结果一致,表明这是一种常见但并非普遍的现象15。在硝酸盐存在下,铁(II)、硫化物和甲烷的生成速率分别小于0.6、0.2和0.05 nmol-ml−1小时−1,无法解释观察到的DIC生产率。我们排除了显着的铁还原速率以及随后以FeS形式捕获Fe2+或吸附到FeOOH上的可能性,因为不会产生碱度(<1.5 nmol ml−1),排除硅藻使用累积的细胞内硝酸盐池17。我们还排除了非生物过程,如碳酸盐溶解驱动DIC生成,因为没有碱度生成。在有氧和缺氧条件下(p=0.76)以及在有无硝酸盐的情况下(方差分析(ANOVA),双因素复制,p=0.44),DIC的产生没有显着差异(图1c);这表明,负责在有氧条件下产生DIC的生物体能够利用能量守恒途径在缺氧条件下维持其代谢,硝酸盐、铁或硫酸盐还原对此没有显着贡献,与图1a、b一致。
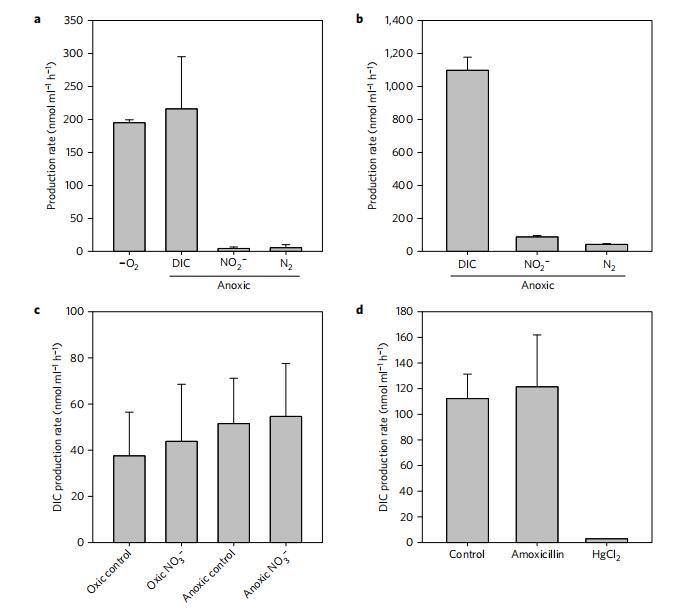
图1|FTR实验中测量的代谢。从澳大利亚菲利浦港湾(a、c、d)和丹麦科特明德(b)收集的沉积物。a、b、氧气消耗量、DIC、亚硝酸盐和二氮(as N)的产生量在测量氧气消耗量后,在实验中切换为缺氧状态,N=4。c、在有氧和缺氧条件下,以及在硝酸盐存在和不存在的情况下,DIC生成率,每个处理n=3。d、缺氧条件下的DIC生成:对照组(n=2),在50 mg l−1阿莫西林(n=2)和2 mmol−1 HgCl2(n=1)。所有误差条均为一个标准偏差
为了阐明缺氧条件下DIC产生涉及的生物群,将含有澳大利亚沉积物的FTR暴露于三种海水储层处理中:对照处理,其中一种加50 mg l−1份阿莫西林,1份加入2 mmol−1氯化汞2。氯化汞处理使DIC的生成停止(图1d),表明碳矿化是由生物过程驱动的。然而,对照组和阿莫西林组的DIC生成率没有显着差异(ANOVA,单因素,p=0.80),表明阿莫西林没有抑制负责碳矿化的主要微生物群落。阿莫西林是一种广谱抗生素,已被证明在0.1至2 mg l浓度范围内具有杀菌作用−1,取决于菌株18。如果细菌导致DIC的产生,我们预计阿莫西林治疗组的DIC产生率会比对照组有所下降。这表明,渗透性沉积物中DIC产生的绝大多数是由真核生物而非细菌引起的。通过量化存在和不存在阿莫西林时的反硝化速率(主要是细菌过程),研究细菌对阿莫西林耐药的可能性(参见补充图1)。正如所料,在整个实验过程中,与对照组相比,阿莫西林抑制反硝化作用的因子为2到5,这表明耐药细菌不能解释我们的观察结果。
可能产生DIC的真核生物包括小型底栖动物、大型动物和微藻。我们排除了大型动物和小型动物的可能性,因为缺氧后DIC的产生持续了10天以上(数据未显示),这会杀死这些生物,并且在沉积物中未观察到大型动物。因此,我们假设DIC产生的来源是微藻,如硅藻、绿藻和其他真核微藻。与此相一致的是,细胞计数显示研究地点有多种微藻群落(见补充表2)。硅藻特别丰富,每毫升超过105个细胞,其中双耳属、球虫属和脆孢属的硅藻种类最多。利用碳与叶绿素a的比率40(参考文献3),将沉积物叶绿素a含量换算为微藻总量,得出沉积物微细胞底栖生物的碳含量为850–860µg−1干沉积物,约占沉积物总有机物含量的57%,突出表明这些生物在DIC生产中可能占主导地位。
缺氧时真核生物的黑暗发酵占主导地位
在证明海洋系统中主要的呼吸电子受体不能解释DIC的产生后,我们寻找了其他可能导致碳矿化的潜在来源。有趣的是,我们通过微传感器实验观察到,氢气开始产生∼缺氧开始后36小时。FTR中的H2浓度达到44±10µmol l−1和23±4µmol l−1(数据未显示)分别在存在和不存在硝酸盐的情况下(图2a)。这些浓度几乎比之前报道的2至6µM细菌发酵产生的最大瞬时H2浓度高一个数量级(参考文献19,20)。这些值对应于26±7 nmol-ml的生产率−1小时−1和13±2 nmol ml−1小时−1,而此时这些色谱柱中DIC的生成率分别为120±46和80±36 nmol-ml−1小时−1分别在含和不含硝酸盐的缺氧处理中(数据未显示)。添加浓度为150µmol l的抗生素环丙沙星−1至色谱柱对产氢没有影响(图2a)。单种分析表明,环丙沙星的EC-50值在15至51 nmol之间−1对于典型的革兰氏阳性菌21、22和241 nmol−1为革兰氏阴性菌putida23。已经证明,真核生物对环丙沙星的敏感度要低得多,因为绿藻物种羊角硒藻(Selenastrum capricornutum)和亚首乌伪麒麟菜(Pseudokirchnerilla subcapitata)的EC-50值在9000 nmol/l之间−1和56000 nmol−1(参考文献24)。尽管存在环丙沙星,但在对照和硝酸盐处理中,H2的生成都持续存在,并且在整个实验过程中确实持续增加。这有力地表明,与DIC生产一样,H2生产不能归因于细菌来源,因此可能是由真核生物产生的,已知真核生物能够在缺氧条件下通过发酵产生H2 25。

图2|渗透性沉积物中的H2和代谢物生成。显示了FTR实验(a–c)和培养物(d)的结果。a、在存在和不存在50µM硝酸盐的情况下产生氢气。实线和虚线表示从有氧条件到缺氧条件的变化,以及添加150µmol l−1个环丙沙星,n=3。b、对照组产氢量和20 mg l−1甲硝唑,n=3。c、与好氧条件相比,制氢过程中代谢物的相对浓度,n=3。d、五种硅藻和一种在黑暗中缺氧培养的绿藻培养物的产氢量,n=6。误差条表示标准偏差。
有两种经过充分研究的真核生物代谢过程可以产生H2:光生物代谢和黑暗发酵代谢25。在光生物生产中,来自水(直接生物光解)或有机化合物(间接生物光解)的光激发电子转移到铁氧还蛋白,然后转移到[FeFe]-氢化酶,从而产生H2 26。相反,黑暗发酵代谢涉及有机化合物(例如,细胞内储存的淀粉)的糖酵解分解。生成的丙酮酸随后被丙酮酸铁氧还蛋白氧化还原酶(PFR)氧化为乙酰辅酶A,生成二氧化碳25。然后乙酰辅酶A转化为储存的脂质。PFR还原的铁氧还蛋白又被[FeFe]-氢化酶再次氧化,产生H2 27。光生物制氢可以排除,因为这些途径需要光照,但所有实验都是在黑暗中进行的。因此,负责观察到的产氢的最可能途径是黑暗发酵代谢。低浓度甲硝唑28可有效抑制还原态铁氧还蛋白向氢化酶的电子转移,而氢化酶是进行黑暗发酵所必需的。与该产氢途径一致,我们观察到服用5 mg l−1与对照治疗相比,甲硝唑有效抑制H2生成(图2b)。
随后,我们研究了通过黑暗发酵产生的有机最终产品的命运。微藻的黑暗发酵除了产生H2和CO2外,还会产生多种有机最终产品,这取决于微藻的种类、途径和环境条件12,29。例如,衣藻分泌醋酸盐、乙醇、甲酸盐或甘油的比例因物种而异30。此外,一些藻类根本不会从细胞中释放发酵产物,而是在细胞内积累。例如,Inui et al.(1982)31发现,细眼虫产生大量蜡酯,这些蜡酯储存在细胞质32中,在恢复到有氧条件下,这些蜡酯被再次氧化生成ATP。我们无法使用固相微萃取(SPME)和GC/MS分析检测柱出水中的任何酒精或挥发性脂肪酸,检测限<1µM,这表明发酵产物主要储存在细胞内。因此,我们对产氢条件下从黑暗缺氧FTR收集的沉积物进行代谢组学分析,以检测可能的储存产物。与有氧条件相比,这表明磷脂和神经酰胺增加了三倍,油酸增加了五倍(图2c)。这与之前针对绿藻(图3)25记录的发酵产物乙酰辅酶A合成脂质的过程一致。
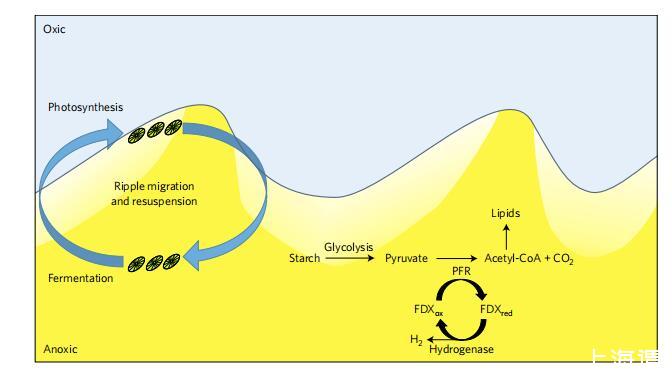
图3|沙沉积物中底栖藻类代谢的概念模型。在这种充满活力的环境中,涟漪迁移和沉积物再悬浮有规律地将藻类细胞移动到许多厘米深的沉积物中,那里是黑暗和缺氧的。在这些条件下,微藻会进行黑暗发酵,产生大量H2和脂质25。酶名称为丙酮酸铁氧还蛋白氧化还原酶(PFR)和铁氧还蛋白(FDX)。轻度阴影区域表示沉积物中的氧浓度下降。黄色阴影区域表示缺氧渗透性沉积物。
反应1和2表明葡萄糖分解生成油酸和其他发酵产物的可能化学计量比,并且在标准条件下是自发的。在非标准条件下,无论H2和CO2分压高(0.8 atm),这两个反应都保持自发;然而,在pCO2和pH2<0.3 atm时,反应2变得最有利(参见补充图2)。
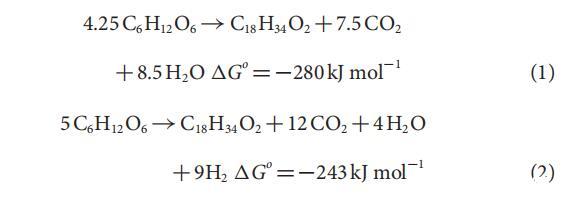
使用反应1和反应2的组合,可以获得大范围的CO2:H2生产化学计量比。直到∼缺氧48小时后,表明在开始类似于反应2的反应之前发生类似于反应1的反应或净H2消耗量。一旦开始净H2生产,其生产时间为∼DIC产量的20%;然而,我们注意到总H2生产率很可能高于此值。与其他沉积物生态系统类似,产生的大部分H2更有可能立即被栖息在沉积物中的呼吸性氢营养细菌回收33。微生物生态学研究表明,这些沉淀物中有大量的好氧和厌氧细菌33-35,其系统类型类似于已知的氢化细菌26、34、35。如果我们假设反硝化作用是主要的电子汇,并且由氢营养作用驱动,2H2:NO3−化学计量比,则总H2产率可能是此处测量的释放量的两倍。目前尚不清楚为什么会释放H2,因为细菌通常会快速消耗H2。我们推测,在高度动态的沙土环境中,细菌生物量无法累积,并且在环境变得更加静态后,细菌生长需要几天到几周的时间才能利用所有的H2。为了支持这一假设,我们观察到沙子变得高度硫化∼从现场收集后1周。
从沉积物中分离出的藻类产生H2
为了进一步证实微藻产生H2,我们从研究地点分离和培养了两个最主要微藻属的代表(见补充表2)。从菲利普港湾分离到五种硅藻(均为脆性硅藻属)和一种绿藻(吡喃单胞菌属)的无菌培养物。在黑暗缺氧条件下培养证实,所有六种培养物都能快速产生H2,在缺氧培养118小时后,浓度达到800±450 nM(图2d)。虽然绿藻可以发酵生成H2(参考文献36),但据我们所知,这是首次观察到硅藻产生H2。之前已经观察到,此类生物体含有发酵产生H2所需的基因(参考文献12),即PFR和[FeFe]氢化酶,从而支持我们的观察结果。人们早就认识到,硅藻可以在黑暗中存活数周37,它们可以通过在黑暗缺氧条件下异化硝酸盐还原来实现这一点38。虽然这种机制在相对富营养化的栖息地(如瓦登海)是可行的,而瓦登海在冬季具有较高的硝酸盐浓度,但这种机制不太可能在相对贫营养的栖息地(如菲利普港湾)是可行的,水柱中的硝酸盐浓度非常低(通常<1µM),并且存在着对少量硝酸盐的激烈竞争。因此,我们提出,发酵是这些优势生物在缺氧期间持续存在的主要机制。
总结
这里给出的结果挑战了在高能渗透沉淀物中使用氧化还原级联的缺氧代谢途径的传统公式39,40。我们在此证明,先前确定的渗透性沉积物中的碳矿化途径(例如,硝酸盐呼吸、硫酸盐和铁还原)和生物体(即呼吸细菌)不能解释缺氧期间DIC的产生。相反,微藻介导的黑暗发酵可能是主要的代谢途径,导致H2释放和DIC生成。考虑到光的穿透足以支持正的净底栖生物群落的产生,可以发生在沿海海洋的33%以上41,这可能是一个全球重要的代谢途径。同样合理的是,产生的H2被好氧和厌氧呼吸细菌循环利用,从而在渗透性沉积物的时空变化生态系统中形成生态和生物地球化学。根据这些发现,我们目前正在研究该生态系统中碳矿化和H2代谢的分子途径。还需要在实际水流环境中进行进一步研究,如原位或水槽中,以调查该生态系统中H2循环的动力学。
方法
方法,包括数据可用性声明和任何相关的加入代码和参考,可在本文的在线版本中获得。
2016年8月8日收到;2016年10月21日接受;2016年11月28日在线发布;2016年12月14日在线更正
 相关新闻
相关新闻