热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
微囊藻菌落可在沉积物中越冬,并可通过补充接种水柱,促进微囊藻水华的年度复发。通过微观实验,通过阐明底栖微囊藻在不同沉积条件下的细胞数量、光合活性和毒素含量动态,定量研究了底栖微囊藻的存活能力。在5°C下22周的实验中,沉积物样品中微囊藻菌落的丰度没有显着降低,而超过90%的底栖生物种群在25°C条件下3个月内死亡。微囊藻菌落在表层沉积物需氧条件下的存活率显着低于深层沉积物厌氧条件下的存活率。毒性铜绿假单胞菌和无毒魏森伯格假单胞菌表现出相似的生存能力,虽然铜绿假单胞菌在15和25°C下的最终存活效率高于威森伯格假单胞菌。微囊藻毒素配额在5和15°C下保持稳定,但在25°C下显着降低。底栖微囊藻群体的光合活性逐渐降低,在较高温度下下降幅度较大。我们的研究表明,大多数底栖微囊藻群体能够成功越冬,微囊藻毒素得以保存,光合活性得以维持,显着增加了水华形成的风险。然而,多年来,它们无法在亚热带浅水湖泊的沉积物中积累。
微囊藻是富营养化淡水中常见的主要成花生物,可产生一系列被称为微囊藻毒素(MCs)的强效肝毒素。在富营养化湖泊中,大量蓝藻微囊藻可能在仲夏和秋季沉入沉积物中,然后在湖底存活(Tsujimura等人,2000年)。沉积物中微囊藻菌落的累积生物量可被视为一个种子库,并可在重新注入水柱后作为中上层水华的接种物,有助于淡水生态系统中这种蓝藻的生态成功和水华形成(Brunberg and Blomqvist 2002;Sabart et al.2014)。Verspagen等人(2005年)模拟了伏尔克拉克湖(荷兰)底栖微囊藻和中上层微囊藻种群之间的关系,发现没有底栖微囊藻的补充,使藻华减少了50%。通过分析太湖(中国)水华的时空模式,发现水华可能首先发生在前一年深秋蓝藻积累的地区(Tan等人,2010年)。在美国伊利湖,调查和分析表明,沉积物最有可能是微囊藻水华的来源(Chaffin等人2014;Sabart等人2014)。鉴于底栖微囊藻的重要性,需要对微囊藻群体的底栖行为进行研究,以更好地了解微囊藻水华形成的机制(Latour等人,2004年;Verspagen等人,2005年)。
目前对微囊藻群落底栖行为的研究主要依靠实地调查。在不同水体的沉积物中观察到大量存活的微囊藻菌落,尽管丰度存在显着差异(Cires等人2013年;Latour等人2004年;Misson等人2012b),从100到200000毫升不等−1(Verspagen等人,2004年),底栖微囊藻的动态可能呈现不同的趋势(Ihle等人,2005年;Tsujimura等人,2000年)。在Quitzdorf水库(德国),底栖微囊藻的生物量在春季末急剧下降,在夏季和冬季保持稳定(Ihle等人,2005年)。在琵琶湖(日本)的浅部,从冬季到初夏,底栖微囊藻的生物量减少,而在瓦伦图纳斯金湖(瑞典)(布伦伯格,1999年)或琵琶湖的深部(70-90米)(Tsujimura等人,2000年)没有记录到生物量下降。在某些沉积物条件下,微囊藻菌落可以存活长达7年(Boström等人,1989年;Latour等人,2007年;Misson等人,2012b)。据我们所知,底栖微囊藻的生存能力尚未得到定量研究。因此,我们旨在确定影响底栖微囊藻菌落存活能力的主要因素,以及这些菌落在各种沉积物条件下的存活时间。
实地调查不足以清楚地揭示微囊藻菌落在沉积物条件下的生存能力,因为底栖微囊藻丰度的减少可能归因于细胞溶解或底栖菌落的补充。为了明确确定沉积物中微囊藻菌落的存活能力,必须抑制浮游和底栖种群之间菌落的交换。因此,需要通过模拟实验进行系统和定量研究,以评估微囊藻菌落在不同沉积条件下的存活能力。此外,只有当它们具有足够的生理活性以恢复生长时,底栖微囊藻群才有可能接种水柱并促进该属的夏季开花特征。使用PhytoPAM检测沉积物中分离的微囊藻菌落的光合作用活性是评估底栖微囊藻菌落恢复生长潜力的有效方法。
有毒和无毒微囊藻菌落总是共存于水体中。有毒和无毒细胞的相对比例以及细胞内的含量水平决定了底栖微囊藻种群的毒性,它们是下一季微囊藻水华的孕育剂。微囊藻物种可以在整个底栖阶段保存MCs;保存在有毒细胞中的MC可能有利于越冬,在沉积物中以及MC含量高或低的有毒细胞之间的生存能力方面,有毒微囊藻物种可能比无毒微囊藻物种具有竞争优势(Ihle et al.2005;Mohamed et al.2006;Latour et al.2007;Misson et al.2012b)。Schatz等人(2007年)证明,微囊藻细胞裂解刺激剩余细胞产生更多MC,从而增强其生存能力。此外,拉图尔等人(2007年)发现,长期掩埋的底栖微囊藻种群的MC含量显著高于新定居种群的MC含量(拉图尔等人,2007年)。因此,确定有毒和无毒微囊藻菌落之间的竞争差异,以及在沉积物条件下有毒细胞中MC含量的动态变化非常重要。
我们在实验室构建了微宇宙,以定量研究微囊藻菌落在各种底栖条件下的生存能力,主要目的是(i)阐明微囊藻菌落在各种沉积物条件下的生存能力,(ii)确定有毒和无毒微囊藻菌落之间是否存在影响底栖生物存活的种间差异,以及(iii)揭示底栖微囊藻的光合活性和细胞内MCs的动态。这项研究的结果将进一步加深我们对底栖微囊藻种群行为和富营养化湖泊中微囊藻水华形成机制的理解。
藻类培养和培养条件
本研究中使用的两种菌落形成微囊藻菌株的纯培养物铜绿微囊藻CHAB 5059和威森伯格微囊藻CHAB 1211由李仁辉教授(中国科学院水生物研究所,武汉,中国)提供。有毒的铜绿假单胞菌菌落含有大量的MC-LR和MC-RR。在卫森伯格支原体细胞中未检测到MCs。如前所述(Tan等人,2010年)分离菌株,并在25°C条件下,在MA培养基中以12小时光照/12小时暗循环培养(Kasai等人,2004年)。在实验之前,对培养物进行放大,直到每个菌落形成微囊藻菌株获得足够的生物量。在整个培养过程中,每个菌株的菌落特征保持不变。
沉积物和水
沉积物和水来自东湖(北纬30°33.0367N,东经114°22.4832E)。沉积物通过60μm的筛子过滤,以防含有可能损坏微电极的大颗粒(OXY25,Unisense,丹麦)。一小部分沉积物经过冷冻干燥、粉碎,并通过60μm的筛子。湖水通过0.45μm的醋酸纤维素膜过滤以去除藻类。
实验环境
本实验使用塑料注射器(50ml);注射器筒的顶部被切断,底部用橡胶柱塞密封(图1)。沉淀物、藻类和过滤水被一层一层地添加到桶中。首先,添加15毫升沉积物作为初始层。添加沉淀物和菌落微囊藻(3 mL)的混合物作为第二层。第三层和第四层分别与第一层和第二层相同。接下来,将0.5g冻干沉淀物均匀地洒在第四层上。最后,缓慢添加10毫升过滤后的湖水作为第五层,以模拟沉积物和微囊藻的再悬浮。注射器筒的外部覆盖着锡箔,顶部覆盖着透气膜。为了比较有毒铜绿假单胞菌和无毒威森伯格假单胞菌的存活能力,将这些装置分为三组,并添加了各种藻类。第一组中添加铜绿微囊藻,第二组中添加魏森伯格微囊藻。在第三组中,将等量的绿脓杆菌和威森贝格氏杆菌混合并添加到桶中(称为微囊藻属)。三组微囊藻菌落的细胞密度均为2.3×108±1.2×107。将微宇宙(图1)置于培养箱中,并在三种不同温度(5、15和25°C)下保持在黑暗中。
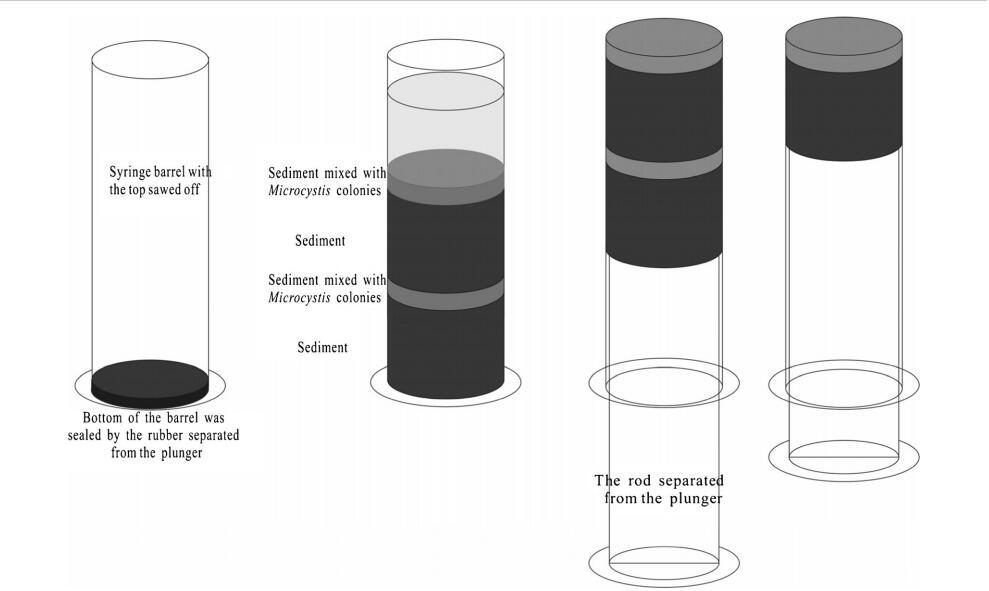
图1模拟微囊藻群落的底栖环境
使用微电极(OXY25,Unisense,丹麦)测量水-沉积物界面的氧气分布,如之前的研究(Tian等人,2015)所述。
取样
我们的前期实验表明,微囊藻菌落的寿命随温度变化很大。因此,针对不同的温度设置了不同的采样间隔。实验持续了22周,每1周、2周或4周采集一次样本。每次取样时,从每组中随机抽取两桶进行取样。
去除覆盖水后,用柱塞杆缓慢排出沉积物芯(图1)。将两层混合沉淀物和微囊藻菌落(即第二层和第四层)切掉并转移到50 mL离心管中,并向每根管中添加15 mL 40%Percoll(瑞典阿默森生物科学公司)溶液。充分混合后,将混合物以4000×g离心10分钟。将含有微囊藻菌落的上清液通过孔径为10μm的筛网过滤,以收集所有蓝藻菌落。然后轻轻冲洗筛子上的微囊藻菌落,并将其悬浮在10毫升MA培养基中,以供日后分析。
微囊藻细胞密度的测定
为了计数底栖微囊藻,将含有微囊藻菌落的10mL MA培养基的等份(各1mL)用0.01mol L水解−如前所述(Wang等人,2015),在85°C温度下使用NaOH进行8分钟,并使用流动摄像机和显微镜(FlowCAM)进行自动研究。
存活率在沉积物中存活一段时间的微囊藻细胞百分比被用来代表微囊藻菌落在不同环境条件下的存活率。
微囊藻的光化学效率分析
PSII的最大光化学效率(Fv/Fm)是使用脉冲调幅荧光监测系统(德国沃尔兹Phyto PAM)测量的。暗适应5分钟后,在弱光条件下(0.15μmol/m)测量原始荧光(Fo)和最大荧光(Fm)−2秒−1)以及3516μmol/m的饱和光脉冲−2秒−分别为1,持续0.8秒。PSII的最大光化学效率(Fv/Fm)计算为Fv/Fm=(Fm)−Fo)/Fm(Wang等人,2014年)。
微囊藻毒素的提取与测定
在4°C条件下,使用3毫升100%甲醇(最终浓度为75%)在含有微囊藻菌落的10毫升MA培养基中提取等份(各1毫升)的MC 24小时。离心后,使用由Waters 2695分离模块、Waters 2996光电二极管阵列检测器和Waters Empower色谱软件(Waters,USA)组成的系统,通过高效液相色谱法(HPLC)测定上清液中的MC含量(Wu等人,2009)。通过比较238nm处的峰面积与MC标准品(美国西格玛·奥尔德里奇)的峰面积来确定MCs的浓度,并在Synergi Hydro RP C18柱(4μm,250mm×4.6mm)上分离MCs。
统计分析
通过重复方差分析(ANOVA)考察了温度、微囊藻种类和沉积层对存活率、光化学效率和微囊藻毒素含量的影响。数据以平均值±标准偏差(SD)表示。Mauchly检验用于通过重复方差分析评估球形度,温室-盖瑟球形度估计用于纠正违反Mauchly检验的数据中的自由度。在三因素重复方差分析中发现显着交互作用的情况下,对每个温度进行单因素方差分析。在进行单因素方差分析后,进行事后Tukey检验以确定显着分组。所有统计分析均使用IBM SPSS Statistics 19软件(美国IBM公司)进行。使用Origin 8.0软件(美国OriginLab)生成图形。