热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
讨论
我们的数据明确显示,反硝化作用是与人类相关的微生物群落中的一个相关过程。迄今为止,人们一直认为人类体内的NO完全还原过程仅限于硝酸盐还原成氨(DNRA)的异纤化过程,因为从人类体内分离出的大多数细菌都能进行这一反应。众所周知,DNRA是一种严格的厌氧过程,在厌氧还原环境中比反硝化作用更受欢迎。因此,在人体肠道的还原性厌氧环境中,二硝化还原反应可能占主导地位,而在氧化程度较高的牙菌斑中则存在反硝化作用。反过来,可以想象DNRA存在于不易被清除的牙菌斑中,因此,牙菌斑一直处于缺氧状态,而且还原程度较高。从理论上讲,在这种生物膜中,NO2-的还原可能与氨的厌氧氧化(anammox)结合在一起(图5,黑色虚线),特别是如果宿主组织或二硝基氧化还原酶的蛋白质降解可以提供氨的来源,正如在海洋开放水域栖息地所报道的那样。不过,在细菌和NO3-共存的其他氧化环境中,也可能存在反硝化作用。例如,除唾液外,NO3-还存在于其他体液中,这些体液可能提供了一个相当氧化的环境(例如,血液中的NO3-为20-40μM,尿液中的NO3-约为500μM)。因此,反硝化作用可能与其他疾病或健康部位的微生物生物膜有关,如囊性纤维化肺、中耳炎耳朵、植入物、导管和阴道粘膜等。
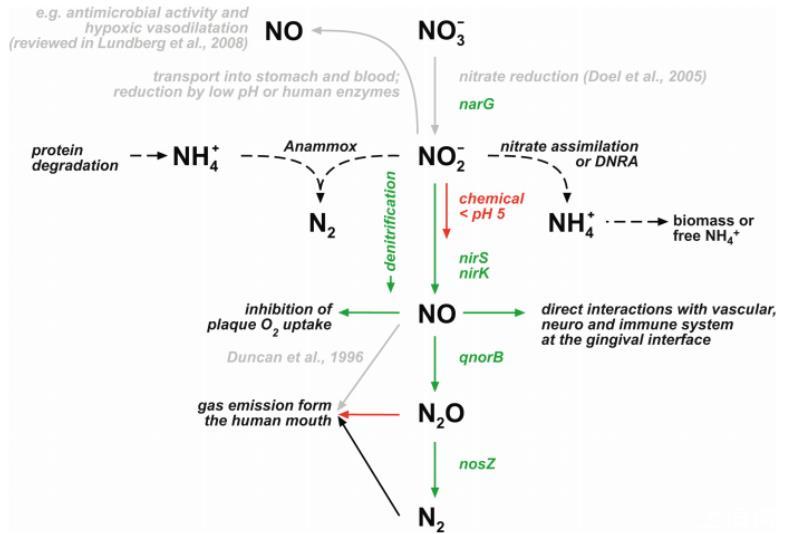
图5、人类牙菌斑中唾液NO3-的微生物转化及其可能的后果。灰色线条表示以前报道过的途径。虚线表示本研究或其他研究中尚未报道的牙菌斑中可能存在的途径。彩色线条表示本研究认为可能存在的途径。绿线表示生物介导的途径,红线表示化学或物理介导的途径。如果通过聚合酶链反应(PCR)在牙科生物膜中检测到了介导反硝化各个步骤的酶的编码基因,则将其描绘出来。未检测到依赖细胞色素c的NO还原酶(cNorB)的基因。Anammox=氨的厌氧氧化;DNRA=将硝酸盐还原为氨。
反硝化和DNRA在最终产物、代谢控制和释放的中间产物方面存在本质区别,因此对宿主的生理机能产生不同的影响。铵是DNRA的最终产物,宿主细胞和相关微生物可将其作为一种固定氮形式利用。此外,人体内的DNRA可能会使铵积累到有害浓度。相比之下,反硝化作用的最终产物N2是宿主固定氮的损失,不会影响人体细胞。此外,微生物反硝化作用产生的信号分子NO可能会影响宿主细胞与其相关微生物群落之间的相互作用。
有趣的是,牙齿生物膜中的反硝化作用是在有氧条件下发生的。这表明牙菌斑并不一定要在缺氧的微环境中才能发生反硝化作用。分离的细菌菌株和微生物群落偶尔也能在有氧气的情况下进行反硝化。在富含NO3-的生境中,有氧反硝化可确保稳定的电子接受过程,该过程暴露于O2浓度的频繁波动中,无需新酶系统的能量需求表达。这可能完全适用于口腔栖息地,因为口腔中唾液NO3-浓度高,O2浓度也可能波动。
尽管牙科生物膜中的微生物种类繁多,但我们只能检测到依赖喹啉型(qnorB)的呼吸型NO还原酶基因,而不能检测到依赖细胞色素c型(cnorB)的呼吸型NO还原酶基因。有趣的是,在非反硝化病原菌中也发现了编码qNorB的基因,在这些病原菌中,qNorB参与NO解毒,而不是呼吸电子传递。显然,在调查的牙科生物膜中,呼吸性NO还原完全由qNorB介导。此外,qNorB还可以作为一种保护酶,抵御来自宿主细胞、NO2-酸性分解物和其他生物膜细菌的有毒NO。
我们的研究结果为牙菌斑中的氮转化建立了一个机理模型(图5)。首先,唾液中的NO3-还原形成NO2-,然后进一步反硝化形成中间产物NO和N2O,最后形成N2(图5,绿线)。除了生物转化步骤外,该机理模型还包括一个由pH值控制的从NO2-到NO的化学转化步骤(图5,红线)。如果酸性发酵使牙菌斑的pH值小于5,就会发生从NO2-到NO的化学转化。在酸性条件下,NO的高周转率会导致牙科生物膜对氧气的吸收减少。这表明牙菌斑中不同微生物活动的代谢耦合是由NO介导的。此外,细菌对作为信号分子的NO也有反应。具体来说,NO参与了细菌从生物膜中的扩散。综上所述,NO可能是平衡天然牙菌斑群落发展的细菌衍生因子。因此,从"生态牙菌斑假说"的角度来看,NO可能是一个重要的因素。"生态牙菌斑假说"认为,口腔中的环境因素(例如pH值和唾液中的NO3-)决定了牙菌斑微生物群落是以维持健康的微生物为主,还是以致病微生物为主。
人体细胞可通过NO合酶活性从精氨酸中产生NO,并对其他细胞产生的NO信号分子做出反应。在牙龈组织中,NO参与血压调节和炎症过程,如牙周疾病。在酸性条件下,牙菌斑中的深度平均NO浓度从0.08μM增加到0.15μM(图2g),处于生理有效范围内,可用于调节局部血压、神经信号转导事件以及调节牙菌斑附近组织的免疫系统。因此,我们假设pH值波动和牙菌斑脱氮可通过调节NO的浓度(图5,绿线)对牙龈局部的血流、神经之间的信号传递和炎症过程产生影响。NO介导的相互作用在致龋斑块与牙周斑块中有所不同,因为两者的pH值不同。致龋菌斑中的低pH值可能会诱导化学NO的形成,从而导致高浓度的NO,而牙周菌斑中NO的形成仅限于微生物过程,因为其pH值大于7。如上所述,微生物反硝化作用可能与人体其他健康和患病部位有关。因此,从更广泛的意义上讲,微生物反硝化作用可被视为人体形成NO的另一种途径,并为人体相关微生物与邻近宿主细胞之间的共生互动提供了基础。
牙菌斑的存在导致口腔空气中作为反硝化中间产物的N2O的积累,这取决于唾液中NO3-的浓度。这表明反硝化作用是在体内进行的,而饮食中NO3-的摄入会影响牙菌斑的反硝化作用。15名未刷牙且唾液中NO3-/NO2-浓度未受操控的志愿者的口腔N2O排放平均速率为80nmol/h。虽然早先对人类呼吸空气进行的调查显示N2O浓度高于环境大气水平,但我们的研究首次提出了这种温室气体的口腔相关排放率。根据我们的数据推断,以目前全球67亿人口计算,人类口腔相关的N2O排放量为0.00013TgN/a,占每年向大气排放的N2O总量16.4TgN/a的0.0008%,微不足道。
牙齿生物膜是人类口腔中产生N2O的主要场所。这一结果和微传感器数据有力地表明,牙菌斑也是口腔中形成其他反硝化中间产物NO2-和NO的主要场所。因此,唾液中NO2-的测量结果并不能充分代表口腔中人类宿主细胞形成NO的情况(图5)。此外,在使用呼气和唾液中的NO和NO2-测量值诊断全身性疾病(如肾衰竭和囊性纤维化)时,需要考虑牙菌斑的反硝化作用。一般来说,与其他口腔表面相比,牙菌斑对反硝化中间产物的形成非常重要,这表明牙菌斑细菌与口腔表面的其他细菌一样对口腔氮转化非常重要。因此,牙齿生物膜和唾液中的NO3-浓度在调节体内NO2-浓度中起着至关重要的作用,并影响人体中与NO2-相关的生理功能,如缺氧性血管舒张和酸性胃中的抗菌活性(图5,灰线)。
许多解剖部位,包括皮肤、口腔、胃、结肠和阴道,都居住着不同的微生物群落,这些群落具有多样性的特点。这表明,由微生物介导的不同代谢途径具有影响人体生理的多功能潜力。然而,与人类相关的复杂微生物群落的活动或功能潜力却很少得到研究。因此,我们预计,如果将与人类相关的微生物群落的研究扩展到碳、硫、铁等元素的循环,利用测量微生物群落原位活动的技术,将能发现微生物与人类之间意想不到的功能和相互作用。可用于这些实验的微生物生态学工具箱包括各种技术,如微电极、同位素或放射性标记,可在大量培养基和单细胞水平上进行检测,所有这些技术都可与系统发育鉴定相结合。这种生态生理学方法可以直接检验在人类微生物组项目背景下产生的元基因组数据中提出的假设。
总结
人类牙菌斑在唾液NO3-的基础上介导反硝化作用。牙菌斑的反硝化作用是在有氧条件下进行的,并以pH值依赖的方式导致生物和化学NO和N2O的形成。牙菌斑对O2的吸收受到NO的抑制。因此,NO的形成介导了菌斑细菌之间的新陈代谢相互作用。此外,NO产生的浓度水平允许向人类宿主细胞发出信号,这表明它在牙龈组织炎症性疾病(即牙周病)的调节中起着重要作用。除了NO合成酶活性和二氧化氮的酸性分解外,微生物反硝化作用也是人类形成NO的另一种途径。牙菌斑中的反硝化作用是人类口腔氮循环中间产物产生的相关场所,并且依赖于唾液中的NO3-。因此,用于检测全身性疾病的呼气分析应考虑牙菌斑的活性,牙菌斑中的反硝化作用可能会影响整个人体的生理机能。