热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
三叉神经痛是最严重的神经病理性疼痛形式,其主要表现为单侧口面部三叉神经支配区域内反复发作的、短暂剧烈的电击或刀割样剧烈疼痛,常由轻触、说话、洗脸等日常无害行为触发。目前,血管压迫尚未进入脑桥的三叉神经根并导致压迫位置局部脱髓鞘被认为是临床上最常见的经典型三叉神经痛的关键病理环节。相应地,三叉神经根微血管减压术对经典型三叉神经痛具有一定程度的治疗效果。然而,有些具有典型症状的三叉神经痛患者要么微血管减压术疗效不佳,要么在其三叉神经根区域并不存在确切的脱髓鞘病变。因此,很有可能是其他区域的神经病变导致此类三叉神经痛。
既往临床研究观察到,继发于多发硬化或者脑桥缺血梗死的三叉神经痛患者很可能是由脑桥三叉神经束(pontine trigeminal tract,PTT)区域的脱髓鞘病变引起的。最近研究进一步发现,很大一部分微血管减压术疗效不佳的三叉神经痛患者全脑范围内仅仅在脑桥三叉神经束区域出现脱髓鞘病变。与此同时,脑桥三叉神经束脱髓鞘病变被发现可以预测微血管减压术治疗三叉神经痛是否有效。这些临床证据提示,除了常见的三叉神经根脱髓鞘,脑桥三叉神经束脱髓鞘同样可能导致具有典型病症的三叉神经痛。然而,目前尚未有临床队列或动物模型研究进一步明确这种临床推测。
溶血磷脂酰胆碱(lysophosphatidylcholine,LPC)常被用于建立中枢神经系统局部脱髓鞘模型。因此,本研究拟利用成年大鼠脑桥三叉神经束LPC的脑立体定位微量注射,建立成年大鼠脑桥三叉神经束局部脱髓鞘模型,通过行为学和药理学检测脑桥三叉神经束局部脱髓鞘能否在成年大鼠上诱发三叉神经痛样行为,从而明确脑桥三叉神经束脱髓鞘可以诱发三叉神经痛。本研究结果将为三叉神经痛的基础研究和临床诊疗奠定一定的基础。
1材料与方法
1.1实验动物
6~7周龄健康清洁级雄性SD大鼠,体质量200~220 g,购自成都达硕实验动物有限公司。大鼠饲养于12/12 h(光照/黑暗)环境中,环境温度控制在(22±1)℃,食水充足且可自由获得。待外购动物适应本实验环境且体质量达到250~270 g时开始实验。以下有关动物的操作流程严格遵守四川大学实验动物福利和伦理相关规定,并尽可能减少实验动物的痛苦,降低大鼠使用量。
1.2主要试剂
LPC购自美国Sigma公司;FluoroMyelin Red髓鞘荧光染料购自美国Invitrogen公司;抗荧光衰减封片剂、卡马西平购自北京索莱宝生物科技有限公司;异氟烷购自深圳瑞沃德生命科技有限公司;羟丙基-β-环糊精购自上海爱必信生物科技有限公司。
1.3实验器材
小动物麻醉系统购自南京卡尔文生物科技有限公司;左臂单臂数显型脑立体定位仪、玻璃微电极注射泵购自深圳瑞沃德生命科技有限公司;玻璃微电极购自丹麦Unisense公司;von Frey纤维丝套件购自美国Danmic Global公司;Air-puff控制系统购自日本MUSASHI公司;IX-83型倒置荧光显微镜购自日本Olympus公司;CM3050型冷冻切片机购自德国Leica公司。
1.4.1脑桥三叉神经束垂直型脑立体定位微量注射
用异氟烷麻醉大鼠后,将大鼠固定于脑立体定位仪。头部剃毛,从大鼠头部中缝处剪开皮肤,暴露术野。参照Wistar大鼠脑立体定位MRI图谱,以Bregma为坐标原点,在其前后径(anterior-posterior,AP):-9.86 mm;内外径(medial-lateral,ML):2.75、2.85、2.95、3.05、3.25 mm处的颅骨表面钻1个小孔,使玻璃微电极垂直进针8.50 mm,停留1 min后以250 nL/min的速度注射20 nL蓝墨水,注射完成后留针5 min,缓慢升起电极。缝合头皮创口并消毒,取下动物待其恢复清醒后放回饲养笼。
1.4.2脑桥三叉神经束倾斜型脑立体定位微量注射
大鼠脑桥三叉神经束ML范围较窄(约0.5 mm),背腹径(dorsal-ventral,DV)范围相对宽厚(约1.8 mm),且在冠状面上呈倾斜弧形(图1),使得垂直型脑立体定位精准微量注射难度较大,故本研究拟进行倾斜型脑立体定位微量注射,以增加微量注射容错率和成功率。动物准备如前所述,在AP-9.86 mm和ML 0 mm处的颅骨表面钻1个小孔,使玻璃微电极左倾斜18°进针9.22 mm,停留1 min后以250 nL/min的速度注射20 nL蓝墨水或者相应剂量的LPC或Vehicle,注射完成后留针5 min,缓慢升起电极。缝合头皮创口并消毒,取下动物待其恢复清醒后放回饲养笼。
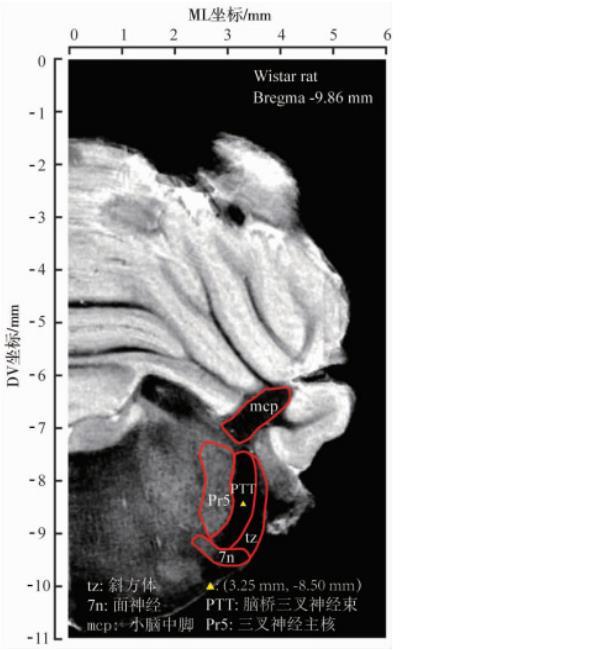
图1 Wistar大鼠脑桥三叉神经束MRI示意图
2结果
2.1成年大鼠脑桥三叉神经束局部脱髓鞘模型的建立
垂直型脑立体定位微量注射实验结果表明,AP-9.86 mm、ML 2.85 mm、DV-8.50 mm是250~270 g体质量的成年雄性SD大鼠脑桥三叉神经束微量注射较为理想的脑立体定位坐标(图2A)。倾斜型脑立体定位微量注射实验结果显示,于AP-9.86 mm、ML 0 mm和DV 0 mm处,将玻璃微电极左侧倾斜18°下行9.22 mm,可使其稳定可靠地定位于脑桥三叉神经束内部(AP-9.86 mm、ML 2.85 mm、DV-8.77 mm;图2B、C)。髓鞘荧光染色结果显示,250 nL的1%LPC即可引起局限于脑桥三叉神经束内的明显脱髓鞘;而更高剂量(500和1 000 nL)的LPC则引发脑桥三叉神经束区域大范围以及脑桥三叉神经束区域外的严重脱髓鞘,且造成脑桥三叉神经束区域内溶胀性空洞等严重组织结构破坏(图2D)。结果表明,1%LPC导致成年大鼠脑桥三叉神经束局部脱髓鞘的最佳剂量为250 nL。
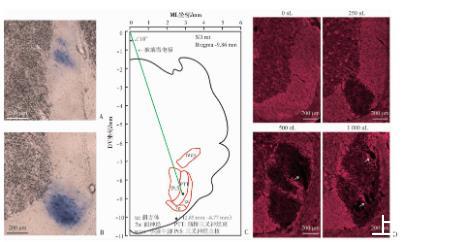
A:脑桥三叉神经束立体定位垂直注射蓝墨水(ML 2.85 mm)分布区域(n=3);B:脑桥三叉神经束立体定位倾斜注射蓝墨水分布区域(n=3);C:SD大鼠脑桥三叉神经束立体定位倾斜注射路径示意图;D:不同剂量1%LPC倾斜注射脑桥三叉神经束后第7天脱髓鞘情况白色箭头:示空洞
图2成年大鼠脑桥三叉神经束局部脱髓鞘模型的建立
3.结论
结合既往基础和临床研究,本研究结果进一步提示,广泛分布于三叉神经传入纤维通路的脱髓鞘病变是三叉神经痛发病的核心通用机制。此推断有以下2方面的意义。一方面,三叉神经痛目前的治疗要么通过以卡马西平为代表的电压门控钠通道抑制剂减弱脱髓鞘神经元的异常兴奋,要么采用侵入性或损毁性的手术治疗解除血管神经压迫或者破坏三叉神经感觉传入;然而三叉神经痛目前的治疗效果皆差强人意。临床队列研究发现,微血管减压术是通过促进髓鞘再生实现对三叉神经痛的治疗。因此,可以开发靶向促进髓鞘再生的治疗手段,单独或者联合现有治疗手段,以期提高三叉神经痛的治疗效果和质量。另一方面,不同位置和不同性质的脱髓鞘病变导致的三叉神经痛虽然临床症状差别不大,但是接受同一治疗方案的效果却存在很大差异。因此,三叉神经痛临床实践中需要扩大影像检查范围从三叉神经根至整个三叉神经传入纤维通路,以便精确判断脱髓鞘病变位置,进而选择合理的治疗方式,实现三叉神经痛的精准治疗,提高该疾病的诊疗质量。
综上所述,本研究表明,除了三叉神经根脱髓鞘,脑桥三叉神经束脱髓鞘同样可以诱发三叉神经痛。该研究结果将为三叉神经痛的机制/治疗研究和临床精准治疗奠定一定的基础。