热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
吴一戎院士(中国科学院空天信息创新研究院)新综述介绍了脑类器官的最新模型进展,它为神经科学和疾病建模领域的研究提供了深入的见解和创新方法。文章首先指出,目前人类神经疾病模型的建立采用的是体内和体外动物模型。但是,由于动物模型无法准确复制人类生理,大约只有三分之一的动物模型能为人类临床试验提供可靠的支持或有效转化。
因此,急需能够准确模拟人类生理的神经病病模型。幸运的是,人诱导多能干细胞(hiPSCs)技术为体外重现人类生理和微环境提供了新的研究可能性,特别是通过发展干细胞衍生的器官芯片。文章深入探讨了使用人诱导多能干细胞衍生神经元(hiPSC-DNs)建立的体外神经病模型的重要性。
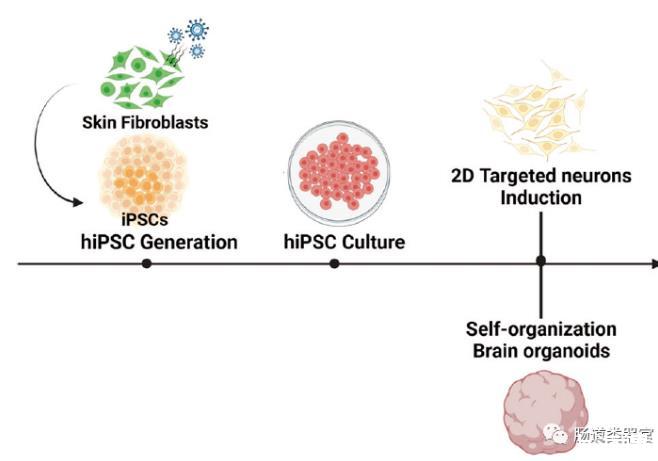
基于3D人脑类器官模型的转录组分析发现,PCCB敲低主要导致了γ-氨基丁酸(GABA)信号通路障碍。进一步的代谢组学分析、ELISA等实验发现,PCCB敲低抑制了三羧酸(TCA)循环关键中间产物α-酮戊二酸、琥珀酰辅酶A和琥珀酸盐的合成,不仅导致了线粒体ATP合成减少、活性氧水平增高,还降低了细胞中GABA的含量。微电极阵列(MEA)电生理检测发现,PCCB敲低导致类脑器官的放电频率增高、同步性降低,表明类脑器官的突触功能和神经网络连接出现障碍。在PCCB敲低的类脑器官培养液中添加外源性α-酮戊二酸可以挽救TCA循环中间产物和GABA含量的减少,表明PCCB通过TCA循环途径发挥作用。
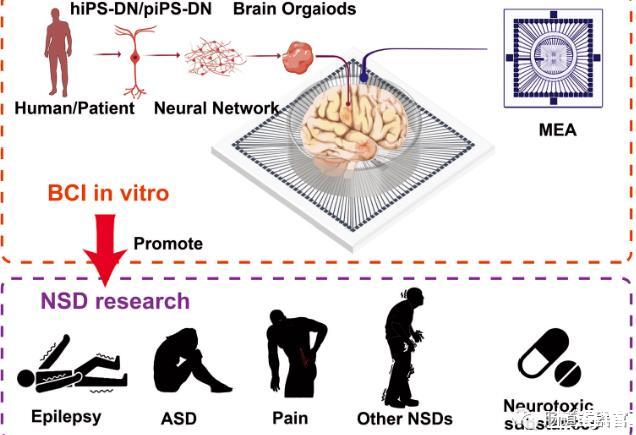
这些模型使用微电极阵列(MEAs)与二维和三维的神经干细胞衍生体外模型界面,以实时监测它们的生理活动。因此,MEAs成为使用人类iPSCs体外模拟神经障碍和疾病的新兴和有用工具。这篇综述详细介绍了MEA在分析hiPSC-DNs建立的神经疾病模型中的作用,涵盖了MEA的制造、表面结构、修饰方案、hiPSC-DNs的培养和信号检测的重要性。
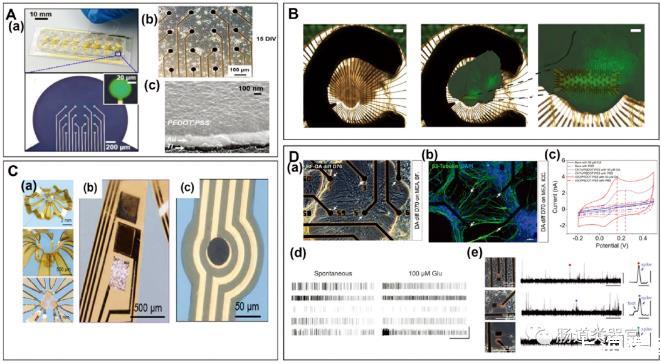
此外,还讨论了MEA技术在研究体外神经疾病模型(包括癫痫、自闭症谱系发育障碍(ASD)等)的进展,以及hiPSC-DNs结合MEA检测体外神经毒性物质的应用。
最后,文章还探讨了多功能集成设备在体外医疗诊断和治疗方面的未来发展和展望。这篇文章是对于神经科学研究者和临床医生来说,尤其是那些对神经疾病建模和干细胞技术感兴趣的人,是一篇不可错过的重要文献。它不仅提供了当前该领域的全面回顾,还为未来的研究方向和应用提供了宝贵的洞见。