热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
Cu2+对NH4+-N、NO3变化的影响−-N、NO2号−-N、和SOP在一个周期内
图2a中的数据表明,在一个厌氧-低溶解氧循环中,对照反应器中NH4+-N的变化与添加Cu2+的反应器中的变化几乎相同,表明Cu2+对硝化作用没有明显影响(p>0.05)。还发现,在Cu2+浓度为100μg/L时,SOP的平均释放和吸收分别为54.8和66.1 mg/L,几乎与对照试验中观察到的结果相同(54.3和65.4 mg/L)(图2b)。如图2所示,两种NO2−-N和NO3−-在厌氧阶段未检测到氮,但在低溶解氧阶段,其浓度随时间增加。在整个低溶解氧期间,NO3的浓度没有显着差异−-氮在两个反应器之间(p>0.05),但添加100μg/L的Cu2+会引起NO2−-氮积累量比对照低38.9%。Catalan Sakairi等人(1997)还发现,将Cu2+添加到60μg/L的浓度可以最小化NO2−-海水生物脱硝过程中氮的积累,但其机理尚未讨论。在本研究中,降低NO2的原因−-在接下来的文本中讨论了添加Cu2+的反应器中低溶解氧阶段的氮积累。
Cu2+对PHA、糖原和SOP转化及活性污泥生长的影响
在厌氧-低溶解氧BNR过程中,在厌氧期间观察到SOP释放、PHA合成和糖原降解,在随后的低溶解氧阶段,PHA被氧化以吸收磷、反硝化、细胞生长和补充糖原。从表2可以看出,两种SBR之间PHA和SOP的转化和细胞生长没有显着差异(p<0.05)。显然,磷累积生物的活性不受Cu2+添加的影响。然而,添加Cu2+导致厌氧或低溶解氧阶段的糖原转化比对照低约25%。
表2添加100μg/L Cu2+对厌氧-低DO BNR过程中PHA、SOP和糖原转化以及活性污泥生长的影响
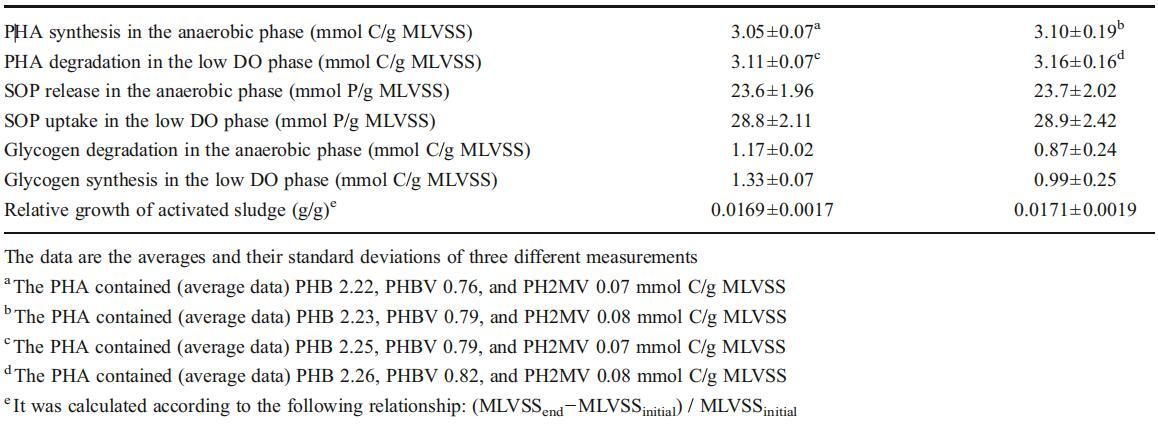
铜离子对反硝化酶活性的影响
反硝化是一种包含四个步骤的金属酶途径(电子补充材料,图S8)。NO3号−还原酶(NAR),NO2−还原酶(NiR)、NO还原酶(NOR)和N2O还原酶(N2OR)是反硝化的四个关键酶。众所周知,亚硝酸盐和N2O的积累分别取决于硝酸盐和亚硝酸盐还原以及NO和N2O还原的相对速率(NO3−→NO2号−→不→氧化亚氮→N2)。如图3a所示,与对照组的0.367 mg N/g MLVSS/min相比,在100μg/L的Cu2+浓度下,NiR活性增加到0.72 mg N/g MLVSS/min,而NAR活性与对照组相比没有显着影响(0.49 mg N/g MLVSS/min与0.45 mg N/g MLVSS/min)(图3b)。因此,Cu2+的加入显着增强了亚硝酸盐的还原,从而减少了NO2−积累随着Cu2+的加入,N2OR的活性从0.047(对照组)增加到0.124 mg N/g MLVSS/min(图3a),而NOR的活性几乎与对照组相同(0.244对0.264 mg N/g MLVSS/min)(图3b)。因此,很容易理解,当添加100μg/L的Cu2+后,N2OR的活性提高2.63倍时,N2O的生成大大降低。
Cu2+对活性污泥中反硝化菌群落的影响
nirS、nirK和nosZ基因在编码反硝化过程中的关键酶(如亚硝酸盐还原酶和氧化亚氮还原酶)中起着至关重要的作用,这些酶可以催化NO2的还原−到NO,最后到N2(Tavares等人,2006年)。因此,根据文献(Geets等人2007年;Henry等人2006年),针对nirS、nirK和nosZ基因的定量实时PCR分析可用于确定反硝化细菌的丰度。图4说明了添加Cu2+后nirS、nirK和nosZ基因拷贝的变化。观察到,添加Cu2+后,nirS和nirK基因拷贝数分别从6.07×106和1.17×106拷贝/g MLVSS增加到6.91×106和1.32×106拷贝/g MLVSS,表明本研究中的反硝化菌数量通过添加低剂量的Cu2+显着增加(p<0.05)。对照和添加Cu2+的反应器中的nosZ拷贝数分别为7.66×106和9.03×106拷贝/g MLVSS(图3)。显然,在添加100μg/L Cu2+后,负责N2O还原的反硝化菌数量显着增加(p<0.05)。
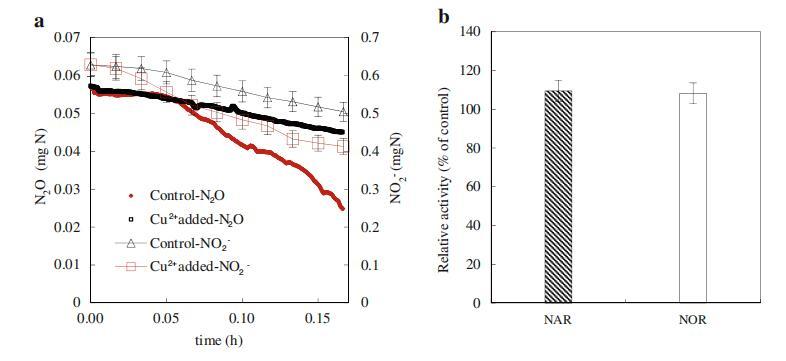
图3 Cu2+(100μg/L)对NiR和N2OR(a)以及NAR和NOR(b)活性的影响。误差条表示三种不同测量的标准偏差
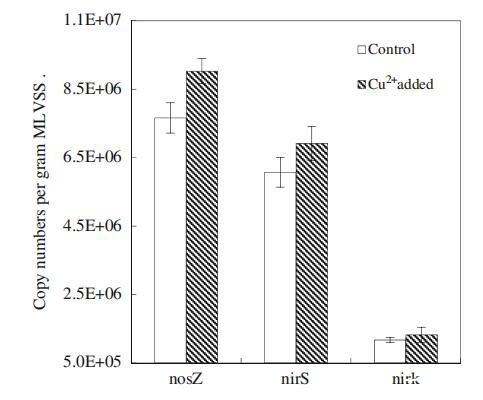
图4 Cu2+对nosZ、nirS和nirK基因拷贝的影响。误差条表示三种不同测量的标准偏差
另外两种BNR工艺在城市污水处理过程中通过控制Cu2+浓度减少N2O排放的可行性
在另两种由实际城市废水供给的BNR工艺(AAA SBR和MAAA SBR)中,研究了Cu2+对减少N2O排放的影响。在AAA SBR和MAAA SBR中TN和TP的去除效率以及N2O的生成相对稳定后,报告了数据(见表3)。
表3其他两种BNR SBR中N2O生成和NH4+-N、TN和TP去除效率的比较
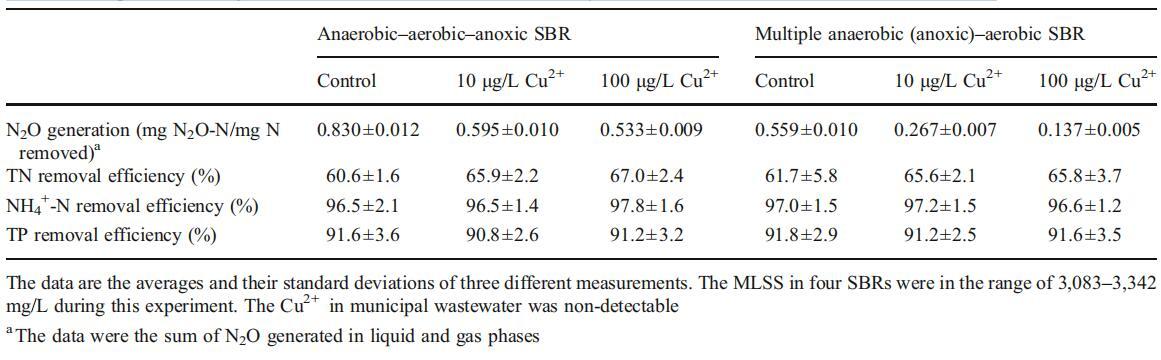
在AAA-SBR和MAAA-SBR的对照反应器中,生成的N2O去除率分别为0.830和0.559 mg N/mg N,当Cu2+浓度为10μg/L时,去除率分别降至0.595和0.267 mg N/mg N,TN去除率分别从60.6%提高到67%(p<0.05)和61.7%提高到65.8%(p<0.05)。Cu2+从10μg/L增加到100μg/L后,N2O的生成量分别降低到0.533(AAASBR)和0.137 g/L(MAAA-SBR),TN去除效率没有显着影响(p<0.05)。从表3可以看出,与对照组相比,添加10或100μg/L的Cu2+不会显着影响NH4+-N和TP的去除效率。当采用厌氧-低溶解氧BNR工艺处理废水时,所有这些观察结果几乎与上文讨论的结果相同。因此,可以得出结论,通过将废水Cu2+浓度控制在10至100μg/L,减少城市污水生物处理过程中N2O的生成是可行的。
据报道,反硝化菌stutzeri会产生缺乏铜的非活性N2O还原酶(Mokhele等人,1987年)。研究还发现,与缺铜培养物相比,增加斯图泽里梭菌和反硝化副球菌培养物中的Cu2+浓度导致N2O气体积累减少和生长加速(Granger和Ward 2003)。从本研究中可以看出,通过将Cu2+浓度控制在10–100μg/L,不仅可以显着减少厌氧-低溶解氧生物废水处理过程中N2O的生成54.4–72.4%,而且可以提高TN的去除效率,而不会对NH4+-N和TP的去除产生不利影响。然而,正如在其他研究中观察到的那样,过量的Cu2+(5000μg/L)对BNR微生物有毒(Ganesh等人,2010年;Wu和Rodgers,2010年)。根据美国环境保护局(2010)的研究,在较低的pH值(<6.5)下,游离铜的毒性水平可能会抑制硝化作用,在较高的pH值(7–8)下,痕量游离铜(100μg/L是最佳浓度)可能会加速硝化作用。在本研究中,pH值在7到8之间变化(电子补充材料,图S9)。因此,当前研究中10–100μg/L的Cu2+的存在应有利于硝化。然而,未观察到Cu2+对硝化的加速作用,可能是因为对照SBR中的氨氮去除效率高达97%。
数据(图1和2b)表明,当只有少量NO2累积时,SBR中N2O的排放率在有氧期的第一个小时内较低(低于0.1μmol/min)(SBR#5除外)−-检测到N。然后,在接下来的1.5小时内,随着NO2的积累,N2O的排放速率增加−-N、一些研究人员报告说,NO2的积累−-由于亚硝酸盐或亚硝酸盐形成的HNO2的毒性抑制了N2O向N2的还原反应,氮在生物脱氮过程中诱导了N2O的积累(Itokawa等人,2001年;Zhou等人,2008年)。亚硝酸盐积累也被认为是自养硝化菌反硝化的原因,其最终产物是N2O(Kampschreur等人,2007年)。据报道,pH值是影响N2O生成的另一个重要因素。Thörn和Sörensson(1996)发现,pH值高于6.8时,缺氧活性污泥中不会形成N2O。当pH值在5到6之间时,N2O产生量最大。在当前研究中,添加Cu2+(100μg/L)的SBR在一个循环中的pH变化与对照SBR中的pH变化几乎相同(电子补充材料,图S9)。因此,影响N2O排放的因素,包括溶解氧、pH、COD/N、SRT和温度,在六种SBR中是相同的,这表明NO2的减少−在低溶解氧阶段通过添加Cu2+积累是降低N2O生成的重要原因。
形成亚硝酸铜还原酶催化中心的铜离子已在大量反硝化菌中被报道(Tavares等人,2006),其耗尽可抑制亚硝酸盐还原酶的合成(Zumft 1997)。如本研究所示,在活性污泥处理废水过程中,添加Cu2+可以显着提高NiR活性,从而减少NO2−反硝化累积。
在本研究中,观察到在污泥浓度(MLSS)约为3200 mg/L的厌氧-低溶解氧BNR工艺处理废水期间,添加Cu2+可提高N2OR活性,在Cu2+浓度为100μg/L时观察到其最大活性(电子补充材料,图S10)。N2OR是一种含双核电子转移位点CuA和催化位点CuZ的铜蛋白(Pomowski等人,2011年)。CuA中心被认为接受来自电子供体(c型细胞色素和/或假天青蛋白)的电子,并将其转移到N2OR蛋白质另一亚单位的相邻CuZ位点,其中N2O结合并还原为N2和水(Pomowski等人,2011)。铜离子是纯反硝化细菌N2O还原酶生物合成的控制因素(Iwasaki等人,1980年),铜离子缺乏会导致反硝化污泥的N2OR活性非常低(Miller等人,2009年)。因此,观察表明,当添加适量的Cu2+时,较高的N2OR活性会导致BNR过程产生较少的N2O。
对活性污泥中nosZ、nirS和nirK基因的实时定量分析表明,添加Cu2+促进了反硝化菌的生长。Pieja等人(2011年)报告称,含有甲烷单加氧酶(一种需要铜的酶)的I型甲烷诺菌的生长可以通过降低培养基中的Cu2+浓度来限制。Granger和Ward的研究表明,当以N2O为基质时,纯反硝化细菌反硝化细菌在富铜培养基中的生长速率是在缺铜培养基中的6倍。这些结果表明,铜离子可能是铜依赖性细菌生长的一个必要因素。还观察到,一些反硝化菌不包含编码N2O还原酶的基因,例如根癌农杆菌C58,这些反硝化菌的最终产物是N2O(Baek等人,2008)。因此,NO2的减少−通过添加Cu2+积累N2O不仅是由于较高的NIR和N2OR活性,而且还直接受到反硝化菌数量增加的影响,尤其是能够还原N2O的反硝化菌。
表2中的数据表明,在低溶解氧阶段,用于糖原合成的PHA消耗较少,而用于反硝化的PHA节省较多,这导致添加Cu2+的反应器中的TN去除效率高于对照反应器(60.6%对70.8%)。通过添加Cu2+改善TN去除的另一个原因是参与反硝化反应的关键酶和微生物增加(图3)。据报道,糖原积累生物(GAO)90%的反硝化最终产物是N2O,这是导致BNR过程中N2O排放增加的主要原因(Lemaire等人,2006;Meyer等人,2005;Zeng等人,2003)。曾等(2003)指出,在BNR系统中,糖原的转化越少,GAO的活性越弱。因此,结果表明,铜离子可能会抑制GAO的活性(见表2),这可能是添加铜的反应器中产生较低N2O的另一种可能机制。
在文献中,当研究生物脱氮除磷时,合成废水或城市废水中的Cu2+浓度通常低于10μg/L(Buzier等人,2006;Zeng等人,2003)。根据本研究结果,从控制N2O排放和促进总氮去除的角度来看,BNR工艺进水中的Cu2+浓度始终不足。此外,本研究发现,约98.6%的进水Cu2+被去除,出水中的Cu2+含量低于2μg/L。美国环境保护局(2007)指出,公有处理厂排放浓度为40-200μg/L的Cu2+不应对水生物种构成威胁。
在通过厌氧-低溶解氧工艺处理废水的过程中,氮的去除会经历硝化作用(NH4+-N被氧化为NO2−-N和NO3−-N)和脱氮(NO2−和NO3−还原为NO、N2O和N2),铜的添加显着影响反硝化作用。此外,本研究表明,铜离子作为一种微量元素,在生物城市污水脱氮除磷过程的反硝化活性(NiR和N2OR)和群落中起着重要作用,适当的铜添加可以显着减少N2O的生成,同时提高生物脱氮过程中的总氮去除率。
致谢
本研究得到了国家863计划(2011AA060903)和污染控制与资源再利用国家重点实验室的资助。
 相关新闻
相关新闻