热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
2.2温度对Anammox-DAMO系统N2O产消过程中EPS的影响
2.2.1温度对Anammox-DAMO系统EPS变化的影响EPS是一种高分子量聚合物,主要由多糖(PS)和蛋白质(PN)组成,可用作保护层,以减弱恶劣环境对微生物的胁迫。此外,EPS在微生物的生物膜形成、粒化和稳定性中起重要作用。由图5可知,两个系统中PN含量的变化占主导地位,PS含量整体变化幅度并不明显,PN含量随着时间的推移先升高后降低,这是由于该体系在试验前期需要通过增加PN含量来维持稳定性。与R1系统不同,在R2系统中,PN含量在中、后期都较初期有更大的增加幅度。
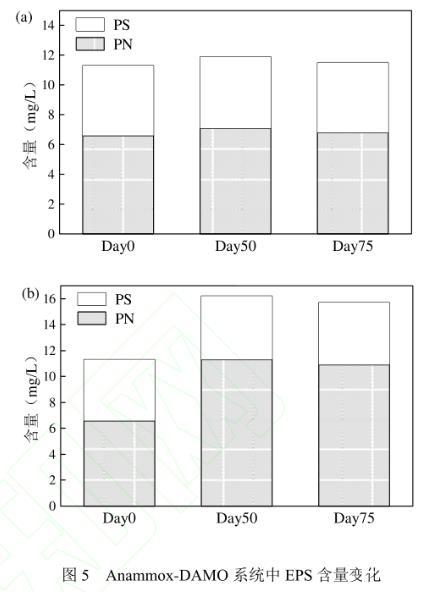
图5 Anammox-DAMO系统中EPS含量变化
总体而言,R2系统在中后期PN和PS的含量都高于R1系统,随着温度的增加,蛋白质和多糖溶解并从污泥中释放出来。R2系统中PN的量要比R1系统显著高很多(P<0.05),这是由于高温胁迫下导致R2系统产生更多的PN以适应环境条件。在整个过程中,各组PN均高于PS,这与其他研究相似0,4.结果表明,R2系统中期的EPS与初期对比起来有所增加,PS含量稳定在4.9mg/L,PN含量由6.6增加到11.3mg/L,可见,相较于PS,高温冲击对PN的影响程度更大,这主要归因于微生物对恶劣环境的自我保护机制。作为影响细胞表面电荷和疏水性的一个因素,较高的PN提高了Anammox-DAMO系统中微生物的粘附性,并减轻了温度冲击对Anammox-DAMO系统微生物的损伤。
R2系统在高温胁迫下产生更多的EPS,导致N2O扩散进入细胞内部的传质阻力增加,N2O还原酶的作用时间缩短使得N2O排放量升高,这与Sabba等的研究结果一致。
2.2.2温度对Anammox-DAMO系统可溶性蛋白影响图6(a)和6(b)为初期(0d)的三维荧光图,发现发射峰位于300——350nm处,激发峰位于250——300nm处,通过与其他研究中荧光组分的激发和发射最大值位置进行比较,该范围内显示荧光激发峰的物质为蛋白质5-4,其中激发峰在250——340nm,发射峰在280——380nm处主要包含物为酪氨酸和色氨酸。激发峰在220——340nm,发射峰在380——520nm处主要包含物为腐殖酸7-5.根据实验结果可知初期实验测得的主要物质是酪氨酸/色氨酸。
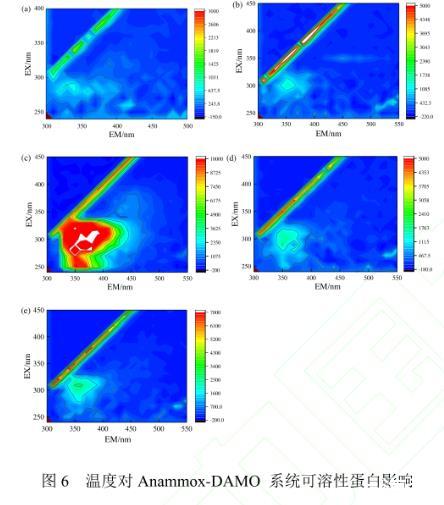
图6温度对Anammox-DAMO系统可溶性蛋白影响
从图6(c)中可知,R1系统三维荧光发射峰位于300——400nm处,激发峰位于250——350nm处,主要物质为酪氨酸/色氨酸、微生物代谢物以及多糖。图6(d)显示R2系统三维荧光发射峰位于300——450nm处,激发峰位于200——350nm处,主要物质为酪氨酸/色氨酸、微生物代谢物、多糖以及富里酸。由图中可得出EPS中蛋白质的荧光强度明显大于多糖、腐殖酸,说明系统中微生物更多的产生蛋白质来适应温度变化对其影响。且R2系统中期的荧光信号要明显强于初期,并且强于同时期的R1系统的荧光信号,表明高温会对反应器中的微生物活动产生影响,从而干扰有机物的分泌,产生更多的酪氨酸/色氨酸。有研究表明色氨酸类和酪氨酸类蛋白质物质与N2O的排放量呈显著正相关关系1-5,因此R2系统中更高的N2O产生量可归因于更多酪氨酸/色氨酸的生成。
从图6(e)可知R1系统三维荧光发射峰位于300——400nm处,激发峰位于200——350nm处,主要物质为酪氨酸/色氨酸、微生物代谢物以及多糖。图6(f)显示R2系统三维荧光发射峰位于300——400nm处,激发峰位于250——350nm处,主要物质为酪氨酸/色氨酸、微生物代谢物、多糖。R2系统末期的荧光信号与中期相比逐渐减弱,逐渐恢复到初期水平,并与R1系统的荧光信号无显著性差异,表明R2中的微生物逐渐适应高温环境,这与系统性能的恶化与恢复趋势一致。
2.3温度影响下Anammox-DAMO系统N2O产消的生物学机制
2.3.1温度对Anammox-DAMO系统微生物群落变化的影响如图7(a)所示,R1和R2的优势菌门均为Proteobacteria,且分别占比33%和40%,它是厌氧氨氧化系统常见的一大门类,且有研究表明Proteobacteria大多数是反硝化细菌,并且Proteobacteria中的大部分菌可以参与甲烷氧化过程,普遍存在于污水处理厂脱氮除磷工艺中。第二优势菌门是Chloroflexi,分别占比14%和17%,它的作用是在细胞生长过程中降解有机分子或分泌可溶性化合物。在温度的影响下,R2系统中的Firmicutes、Chloroflexi、Bacteroidetes和Euryarchaeota等嗜热微生物丰度上升。相反在高温胁迫下Actinobacteria和Ignavibacteriae的丰度相比R1有所下降,说明高温环境不利于其生存。
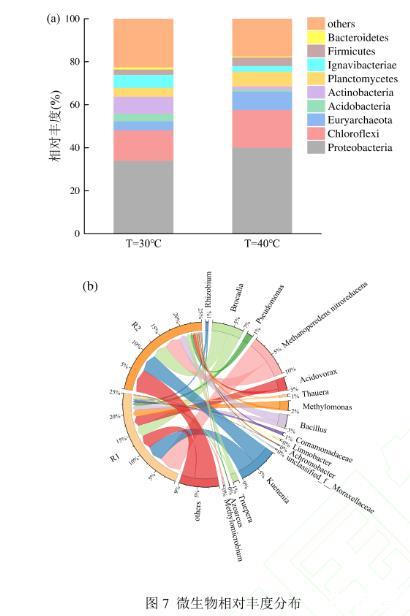
图7微生物相对丰度分布
图7(b)显示2个系统中均发现了芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonad)、食酸菌属(Acidovorax)、陶厄氏菌属(Thauera)、甲基单胞菌属(Methylomonas)、Methanoperedens nitroreducens、丛毛单胞菌属(Comamonadaceae)、特吕珀菌属(Truepera)、Kuenenia、甲烷微菌属(Methylomicrobium)。Acidovorax是常见的反硝化菌,Thauera是自养型反硝化细菌4-5,相比于R1系统,这两种菌属丰度在R2系统中均有所下降,表明高温环境会抑制其生长。Tanikawa等认为Acidovorax和Thauera是反硝化过程中主要的N2O还原剂,Zhao等在Thauera中检测到了大部分N2O还原酶编码基因,证明了Thauera在N2O还原过程中的巨大贡献,R2系统中Thauera丰度的下降是N2O积累量更多的原因。另外,有研究证明Bacillus可能在N2O排放方面发挥巨大作用,本文在R2系统中检测到了该属更高的丰度,这也是导致N2O排放量更高的重要原因。Methylomonas中存在亚硝酸盐还原酶,其在R2系统中的丰度明显低于R1系统,导致R2系统亚硝酸盐大量积累。Methanoperedens nitroreducens已知为进行硝酸盐驱动的厌氧甲烷氧化的n-DAMO古菌,在R1系统中的占比为23.22%,在R2系统中的占比为16.40%,由此可见高温抑制了DAMO古菌的生长,造成脱氮速率下降。Ca.Kuenenia和Ca.Brocadia与脱氮直接相关,是常见的Anammox细菌,在R1系统中两者的占比分别为17.64%和12.47%,在R2系统中两者的占比分别为19.01%和16.65%,可以看出Anammox两个菌属在R2中占比升高。这可能是因为DNRA反应产生的铵促进了Anammox微生物的生长。在两个系统中均未检测到能够进行DNRA反应的典型微生物,因此推测DAMO古菌利用甲烷厌氧氧化产生的电子发生了DNRA反应。
2.3.2温度对Anammox-DAMO系统微生物功能基因丰度变化影响反硝化过程主要由4种酶催化,即硝酸盐还原酶(narGHI/napAB)、亚硝酸盐还原酶(nirK/nirS)、NO还原酶(norBC)和N2O还原酶(nosZ)。nrfA是DNRA的分子标志物,由图8可见,其在R2系统中相对丰度较高,对高温条件表现出明显的偏好性,Lai等将温度从10℃提升到40℃时,nrfA基因丰度增加,DNRA反应过程增强,说明DNRA反应与nrfA基因丰度呈显著正相关。对于硝酸还原酶基因,相较于R1系统,R2系统中的napAB转录明显上调,显示了对DNRA的主要贡献(硝酸盐被还原为亚硝酸盐),然而narGHI的表达水平与R1系统几乎一致,表明对部分DNRA的贡献较小。对于亚硝酸还原酶基因,nirSK在R2系统中的相对丰度低于R1系统,减弱了R2系统对亚硝酸盐还原能力进而导致亚硝酸盐积累,这主要归因于高温会显著降低nirK基因的丰度。另外,在R2系统中,NO还原酶基因(norB)相对丰度更高,而N2O还原酶基因(nosZ)相对丰度较低,说明高温条件抑制了nosZ酶的生成,进而阻碍了N2O被还原。hdh和hzs是参与Anammox反应的酶,其中hzs在R2中的相对丰度高于R1系统,且与nrfA的变化呈正相关关系,表明DNRA反应产生的铵为Anammox提供了底物,从而促进Anammox过程的发生。
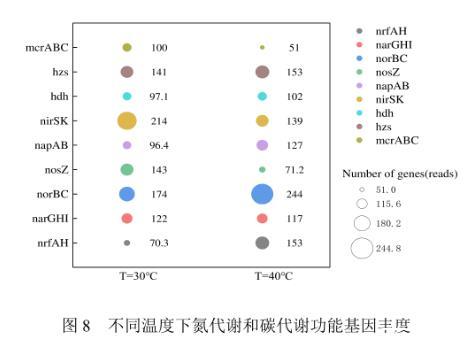
图8不同温度下氮代谢和碳代谢功能基因丰度
在R2系统中,Anammox基因丰度高,但脱氮性能却比R1差。这种现象可以通过不利的温度和FNA对转录、翻译和酶活性的抑制来解释。以亚硝酸盐还原酶与N2O还原酶的比值(Σnir/nos)作为N2O产生潜力的指标,其中Σnir/nos是由nir基因(nirS+nirK)之和除以nos基因测定的。结果表明R2系统中Σnir/nosZ(1.95)高于R1系统(1.49),说明Anammox-DAMO系统在高温胁迫下更易积累N2O.
2.4温度影响下Anammox-DAMO系统动力学机制及N2O减排调控策略
2.4.1温度影响下Anammox-DAMO系统动力学机制如图9及表1、2、3所示,NO3-、NH4+和N2O酶动力学方程中Vmax均随着温度的升高先增大后减小,在35℃时最大,40℃时最小,意味着硝酸盐还原酶、亚硝酸盐还原酶、N2O还原酶均在35℃时拥有最大比合成/活化速率,酶活性最强。KI,R为对应还原酶的抑制系数,3种酶动力学方程的KI,R随温度的升高先降低后升高,同样在35℃时最大,40℃时最小,表明35℃的温度条件对3种酶的抑制作用最小。3种酶动力学方程的半饱和常数KE,i随着温度的升高先减少后增加,在35℃时最小,40℃时最大。
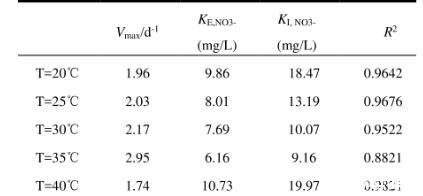
表1不同温度下NO3-降解酶动力学参数
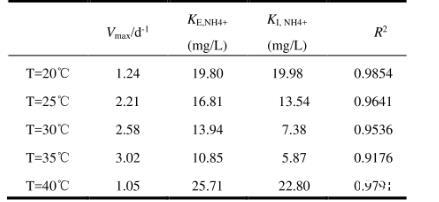
表2不同温度下NH4+降解酶动力学参数
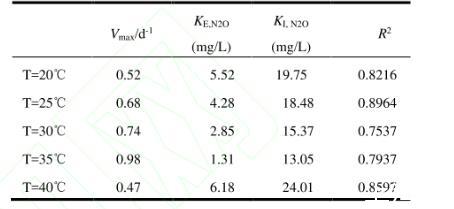
表3不同温度下N2O消耗酶动力学参数
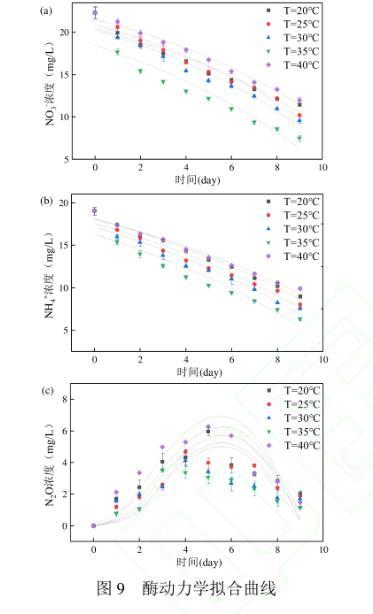
图9酶动力学拟合曲线
硝酸盐还原酶、亚硝酸盐还原酶、N2O还原酶的活性均随着温度的升高呈现先增强后减弱的趋势,且在35℃时活性达到最大,意味着在此温度下Anammox-DAMO系统的脱氮性能最好,N2O还原效果最好,能够实现最大程度减少N2O排放量。低于或高于35℃的温度条件都会对酶的活性产生不利影响,造成系统性能的恶化以及N2O的积累,拟合结果印证了短期试验结果。Hu等利用实验室规模的缺氧/好氧间歇式反应器探究了温度对N2O排放的影响,结果表明在10——35℃的温度条件下,N2O排放量随温度的升高而降低,该系统主要是通过温度变化影响硝化和反硝化的总体过程速率来影响N2O的排放,本研究在该温度范围的基础上继续扩大温度范围,发现在20——40℃的范围内,系统在35℃时出现N2O排放低谷。此外,Qian等在TDD-Anammox耦合工艺中发现35℃时系统N2O排放量最少,这主要归因于Anammox微生物(其特征是不产生N2O)在此温度下发挥最大作用,而本研究酶动力学拟合结果证明了参与Anammox过程的亚硝酸盐还原酶在35℃下活性最大,与其实验结果相符。
综上所述,动力学模型可以很好地预测系统在不同温度下N2O排放情况,根据酶动力学拟合结果推测出N2O排放量最少的温度条件为35℃,在此温度下该系统可以最大程度地实现N2O减排。
2.4.2 Anammox-DAMO系统代谢途径及N2O调控策略根据检测到的功能菌和基因,通过比对KEGG数据库的注释对温度影响下Anammox-DAMO系统特殊氮代谢途径进行分析(图10)。
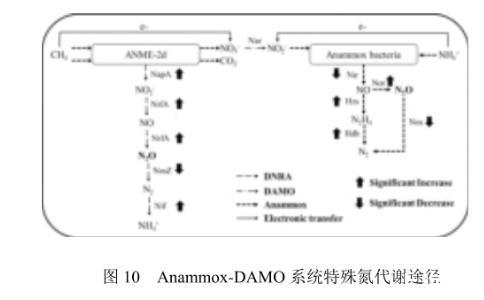
图10 Anammox-DAMO系统特殊氮代谢途径
在Anammox-DAMO系统中,除已被证实的Anammox-DAMO氮代谢基因,还检测到了与DNRA反应相关的nrfA基因,且在高温胁迫下其丰度显著增加。研究表明DAMO古菌有编码nrfA的基因,因此具有发生DNRA反应的潜力。高温抑制了Anammox-DAMO系统中nir酶的活性,造成亚硝酸盐积累,基于nrfA的解毒机制,此时nrfA会将NO2-还原为NO,nrfA与活性位点血红素c基团A结合的晶体结构将NO转化为N2O.在本研究中还检测到了与N2O产消相关的norB、norC和nosZ基因。有研究表明,Anammox细菌会生成中间产物NO,norB和norC基因可能会对外部亚硝化应激做出快速反应,为了将NO维持在毒性水平以下会把NO转化为N2O.高温影响下,Anammox细菌产生的NO促进了norBC基因丰度增加,进而将更多的NO转化为N2O.与此同时,Anammox-DAMO系统中的nosZ基因丰度降低,说明高温抑制了N2O还原酶的生成,导致无法及时将产生的N2O还原,造成N2O净排放量升高。综上所述,N2O产生和消耗途径可作如下解释:Anammox-DAMO系统中检测到的N2O由DNRA反应及Anammox细菌对NO解毒作用产生,而N2O的消耗大部分由编码nosZ基因的微生物完成。
基于Anammox-DAMO系统中N2O特殊的产消代谢途径,本研究发现高浓度亚硝酸盐胁迫是导致Anammox-DAMO系统N2O积累的主要原因。高温通过影响系统氮代谢过程中的关键功能基因酶的活性,导致亚硝酸盐浓度升高,进而触发DNRA反应及Anammox细菌的解毒作用。反硝化过程中4个还原步骤之间的电子竞争以及不同还原酶的活性决定了N2O的积累程度,本研究中,对系统性能不利的高温条件会显著降低N2O还原酶的活性,导致N2O的净排放量升高。因此,尽可能控制系统在运行过程中维持在中温条件,丰富具有较强N2O还原能力的微生物群,可以促进N2O的还原。在后续研究中,还需要优化pH值、C/N、DO、FNA等其他操作条件,避免运行过程中亚硝酸盐的积累,并研究不同操作条件下N2O还原酶的活性,以最大限度地减少废水处理中N2O的产生。
3结论
3.1高温显著降低了Anammox-DAMO系统的脱氮性能,且在高温胁迫下系统中亚硝酸盐积累进而导致N2O的净排放量升高,根据甲烷与硝酸盐降解速率比值可知该系统在长期运行过程中还存在DNRA反应。
3.2 Anammox-DAMO系统中微生物在高温胁迫下产生更多的蛋白质以缓解恶劣环境造成的损伤,三维荧光光谱结果显示其主要为色氨酸类和酪氨酸类蛋白质物质,该类物质的分泌与N2O的排放量呈显著正相关。
3.3高通量测序结果表明,在高温影响下系统中与N2O还原相关的Acidovorax和Thauera属丰度降低,而与N2O产生相关的Bacillus属丰度则上升。宏基因测序结果表明高温降低了nirSK丰度,造成亚硝酸盐积累,此外在高温条件下norB丰度增加而nosZ丰度减少,加速了N2O生成的同时抑制了其还原,导致N2O积累。
3.4在不同温度下对Anammox-DAMO系统进行酶动力学拟合,发现低温和高温均会增加N2O的净排放量,而在35℃时可以最大程度地实现N2O减排。